плутоний
ПЛУТОНИЙ (от назв. планеты Плутон; лат. Plutonium) Pu
искусств. радиоактивный хим. элемент III гр. периодической системы, ат. н. 94, ат. м. 244,0642; относится к актиноидам. Стабильных изотопов не имеет. Известны 15 изотопов с мас. ч. 232–246. Наиб. долгоживущие изотопы — 244Pu (T1/2 8,26∙107 лет), 242Pu (T1/2 3,76∙105 лет, поперечное сечение захвата тепловых нейтронов σ 1,9∙10− 27 м2), 239 Pu (T1/2 2,41∙104 лет, σ 2,71∙10− 26м2) и 238Pu (T1/2 87,74 г, σ 5∙10−26 м2)-α-излучатели. В природе П. встречается в ничтожных количествах в урановых рудах (239 Pu); он образуется из U под действием нейтронов, источниками которых являются реакции (a,n), протекающие при взаимодействии α-частиц с легкими элементами (входящими в состав руд), спонтанное деление ядер U и космич. излучение. Конфигурация внеш. электронных оболочек атома 5s2 5p65d105f 66s26p67s2; степень окисления от + 3 до + 7, наиб. устойчива + 4; электроотрицательность по Полингу 1,2; атомный радиус 0,160 нм, ионные радиусы Pu3+, Pu4+, Pu5+ и Pu6+ соотв. 0,0974, 0,0896, 0,087 и 0,081 нм.
Свойства. П. — хрупкий серебристый металл. Существует в шести кристаллич. модификациях (табл. 1); т. пл. 640 °C, т. кип. 3352 °C; рентгеновская плотн. 19,86 г/см3; 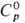 32,77 Дж/(моль∙К);
32,77 Дж/(моль∙К); 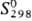 56,46 Дж / (моль∙К); уравнение температурной зависимости давления пара над жидким П.: lg p (мм рт. ст.) = -17120/T+ 4,592 (1210–1620 К); теплопроводность 0,033 Вт/(см∙К) (313 К); ρ 145 мкОм∙см для α-Pu; парамаг-нетик, магн. восприимчивость изменяется от 2,52∙10−6 (при 140 °C, β-Pu) до 2,35∙10− 6 (400 °C, d-Pu); γ жидкого П. при 640 °C (0,437–0,475)∙10− 2 Н/см; уравнение температурной зависимости вязкости lg η = 672/T+ 0,037 (920- 1220 К); при нагр. от 310 °C до 480 °C сжимается.
56,46 Дж / (моль∙К); уравнение температурной зависимости давления пара над жидким П.: lg p (мм рт. ст.) = -17120/T+ 4,592 (1210–1620 К); теплопроводность 0,033 Вт/(см∙К) (313 К); ρ 145 мкОм∙см для α-Pu; парамаг-нетик, магн. восприимчивость изменяется от 2,52∙10−6 (при 140 °C, β-Pu) до 2,35∙10− 6 (400 °C, d-Pu); γ жидкого П. при 640 °C (0,437–0,475)∙10− 2 Н/см; уравнение температурной зависимости вязкости lg η = 672/T+ 0,037 (920- 1220 К); при нагр. от 310 °C до 480 °C сжимается.
Компактный П. медленно окисляется на воздухе, порошок и стружка пирофорны; медленно взаимод. с водой, раств. в соляной кислоте, HClO4, HBr и H3PO4, пассивируется конц. HNO3, CH3COOH и H2SO4; в растворах щелочей заметно не растворяется. При 50–300 °C П. взаимод. с H2, давая гидрид PuH2+х (x = 0–0,7)-черные кристаллы с кубич. гра-нецентрир. решеткой. При избытке H2 образуется три-гидрид PuH3-черные кристаллы с гексагон. решеткой (а = 0,378 нм, с = 0,676 нм, пространственная группа P63/mmc); 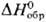 −193,2 кДж/моль. Для дигидрида PuH2
−193,2 кДж/моль. Для дигидрида PuH2 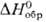 −156,7 кДж/моль (923 К); уравнение температурной зависимости давления разложения: lgp 1( мм рт. ст.) = 10,01 — 8156/T (400–800 К); выше 400 °C в вакууме разлагается с образованием мелкодисперсного П.; на воздухе быстро окисляется при 150 °C; разлагается соляной и серной кислотами; используют в качестве исходного вещества для синтеза др. соед. Pu.
−156,7 кДж/моль (923 К); уравнение температурной зависимости давления разложения: lgp 1( мм рт. ст.) = 10,01 — 8156/T (400–800 К); выше 400 °C в вакууме разлагается с образованием мелкодисперсного П.; на воздухе быстро окисляется при 150 °C; разлагается соляной и серной кислотами; используют в качестве исходного вещества для синтеза др. соед. Pu.
При прокаливании оксалата, пероксида и др. соединений П. на воздухе или в атмосфере O2 при 700–1000 °C получают диоксид PuO2; уравнение температурной зависимости давления пара: lg p (мм. рт. ст.) = 8,072 — 29240/T(2000–2400 К); не раств. в воде и органических растворителях, медленно взаимод. с горячей смесью конц. HNO3 с HF (см. также табл. 2); PuO2-весовая форма при определении П., его используют также для приготовления топлива в ядерной энергетике. Сескви-оксид Pu2O3 (т. пл. 2085 °C), синтезированный нагреванием PuO2 и углерода в токе Не при 1625 °C, имеет гексагон. кристаллич. решетку (а = 0,3841 нм, с = 0,5958 нм, пространственная группа Р3тb); 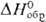 — 1688,6 кДж/моль; Pu2O3, полученный восстановлением PuO2 металлическим П. или гидридом П. при 1500 °C, — кристаллы с кубич. объемноцент-рир. решеткой (а = 1,104 нм, пространственная группа Ia3, α-форма) или с кубич. гранецентрированной решеткой (а = 0,5409 нм, a'-форма).
— 1688,6 кДж/моль; Pu2O3, полученный восстановлением PuO2 металлическим П. или гидридом П. при 1500 °C, — кристаллы с кубич. объемноцент-рир. решеткой (а = 1,104 нм, пространственная группа Ia3, α-форма) или с кубич. гранецентрированной решеткой (а = 0,5409 нм, a'-форма).
Гидраты пероксида PuO4∙nH2O (п = 2, 3) образуются при добавлении H2O2 к кислым растворам соединений П.; плохо раств. в воде и органических растворителях; при нагр. превращ. в PuO2. Гидроксид Pu(OH)4 ∙ xH2O получают при действии щелочи на растворы Pu4+ ; произведение растворимости 7∙10−56, растворимость при 25 °C в 1 M растворе Na2SO4 (pH 6,2) 5,9 мг/мл, в 1 M растворе Na2CO3-1,572 мг/л, в насыщ. растворе KCl-6,92∙10−6 моль/л.
Гексафторид PuF6-T. кип. 62,2 °C; 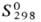 220,7 Дж/(моль∙К); уравнения температурной зависимости давления пара: над твердым PuF6 lg p (мм рт. ст.) = — 2095/T+ 3,499 (273–324,59 К), над жидким- lg p (мм рт. ст.) = — 1807,5/T- 1,5340 (324,59 — 350,17 К); сильный фторирующий агент и окислитель; бурно реагирует с водой; получают действием F2 на PuF4 или PuO2 при 600–700 °C. Тетрафторид PuF4 -т. кип. 1277 °C; С0р 116,36 Дж/(моль∙К);
220,7 Дж/(моль∙К); уравнения температурной зависимости давления пара: над твердым PuF6 lg p (мм рт. ст.) = — 2095/T+ 3,499 (273–324,59 К), над жидким- lg p (мм рт. ст.) = — 1807,5/T- 1,5340 (324,59 — 350,17 К); сильный фторирующий агент и окислитель; бурно реагирует с водой; получают действием F2 на PuF4 или PuO2 при 600–700 °C. Тетрафторид PuF4 -т. кип. 1277 °C; С0р 116,36 Дж/(моль∙К); 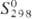 167,14 Дж/(моль∙К); уравнение температурной зависимости давления пара: lg p (мм рт. ст.) = 5,58 — 10040/T (700–1200 К); плохо раств. в воде и органических растворителях; получают нагреванием PuO2 или PuF3 в токе HF и O2 при 450–600 °C. Трифторид PuF3, трихлорид PuCl3 (т. кип. 1767 °C) и трибромид PuBr3 синтезируют взаимод. PuO2 соотв. с безводным HF (при 250–300 °C), HCl (CCl4 или SCl2 выше 750 °C) и HBr (при 800 °C), трииодид PuI3-взаимод. безводного газообразного HI с металлическим П. при 450 °C.
167,14 Дж/(моль∙К); уравнение температурной зависимости давления пара: lg p (мм рт. ст.) = 5,58 — 10040/T (700–1200 К); плохо раств. в воде и органических растворителях; получают нагреванием PuO2 или PuF3 в токе HF и O2 при 450–600 °C. Трифторид PuF3, трихлорид PuCl3 (т. кип. 1767 °C) и трибромид PuBr3 синтезируют взаимод. PuO2 соотв. с безводным HF (при 250–300 °C), HCl (CCl4 или SCl2 выше 750 °C) и HBr (при 800 °C), трииодид PuI3-взаимод. безводного газообразного HI с металлическим П. при 450 °C.
Табл. 1 — ХАРАКТЕРИСТИКА КРИСТАЛЛИЧЕСКИХ МОДИФИКАЦИЙ ПЛУТОНИЯ
таблица в процессе добавления
Табл. 2 — ХАРАКТЕРИСТИКА СОЕДИНЕНИЙ ПЛУТОНИЯ
таблица в процессе добавления
Моносульфид PuS синтезируют восстановлением PuF3 парами Ba в тигле, изготовленном из BaS, при 1250 °C, действием паров S на металлический П. (стружка) при 300 °C или нагреванием гидридов П. в токе H2S до 400–600 °C. Сульфид состава Pu2S3-Pu3S4 получен нагреванием PuCl3 в токе H2S при 840–916 °C. Известен монофосфид PuP, который образуется при взаимодействии П. с парами P при 650–805 °C. Соединения П. с кремнием-моносили-цид PuSi, сесквисилицид Pu2Si3 и дисилицид PuSi2-синтезируют взаимод. PuO2, PuF3 или металлического П. соотв. с SiC, Si и CaSi2 при высоких температурах.
Формальные окислит. потенциалы П. (в В) в 1 M растворе HClO4:
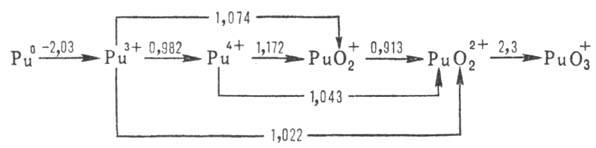
П. в степени окисления + 7 впервые получили в 1967 H. H. Крот и А. Д. Гельман окислением 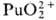 озоном в щелочной среде. В кислых водных растворах П. существует в виде ионов Pu3+ (для водного раствора
озоном в щелочной среде. В кислых водных растворах П. существует в виде ионов Pu3+ (для водного раствора 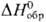 —591,2 кДж/моль, цвет в растворе сине-фиолетовый), Pu4+ (для водного раствора
—591,2 кДж/моль, цвет в растворе сине-фиолетовый), Pu4+ (для водного раствора 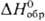 −541,3 кДж/моль, желто-коричневый),
−541,3 кДж/моль, желто-коричневый), 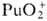 (для водного раствора
(для водного раствора 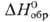 — 923,8 кДж / моль, светло-розовый),
— 923,8 кДж / моль, светло-розовый), 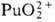 (для водного раствора
(для водного раствора 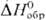 — 819,6 кДж/моль, розово-оранжевый). Ионы Pu4+ и PuO+2 в водных растворах диспропорционируют:
— 819,6 кДж/моль, розово-оранжевый). Ионы Pu4+ и PuO+2 в водных растворах диспропорционируют:
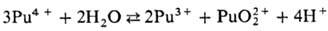
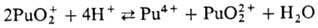
Склонность ионов П. к диспропорционированию и комплек-сообразованию уменьшается в ряду Pu4+>Pu3+> > 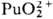 >
> 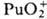 . Pu(IV) можно получить окислением Pu(III) в кислых растворах ионами
. Pu(IV) можно получить окислением Pu(III) в кислых растворах ионами 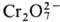 ,
, 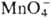
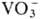
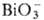 _и Ce4+, а также при восстановлении Pu(VI) ионами Fe2+, I− ,
_и Ce4+, а также при восстановлении Pu(VI) ионами Fe2+, I− , 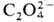 . Pu(IV) образует полимерные цепи даже в кислых растворах, скорость полимеризации определяется концентрацией кислоты и П., присутствием др. ионов и температурой. Pu(VI) можно получить окислением Pu(III) или Pu(IV) в растворах HNO3 ионами Ag2+,
. Pu(IV) образует полимерные цепи даже в кислых растворах, скорость полимеризации определяется концентрацией кислоты и П., присутствием др. ионов и температурой. Pu(VI) можно получить окислением Pu(III) или Pu(IV) в растворах HNO3 ионами Ag2+, 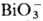 ,
, 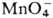 или
или 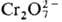 в разб. HClO4, а также действием O3, Ce4+.
в разб. HClO4, а также действием O3, Ce4+.
Получение. Наиб. важный в практич. отношении изотоп 239Pu получают в ядерных реакторах при длит. облучении нейтронами прир. или обогащенного U:
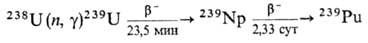
При захвате нейтронов 239Pu образуются более тяжелые изотопы П. с мас. ч. 240-242:
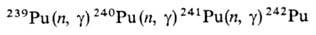
Одновременно в результате ядерной реакции образуется 238Pu:
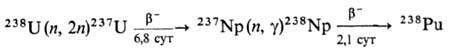
Обычно содержание 239Pu в смеси составляет 90–95%, 240Pu-1–7%, содержание др. изотопов не превышает десятых долей процента. Долгоживущие изотопы Pu и 244Pu получают при длит. облучении нейтронами 239Pu. Выход 242Pu составляет неск. десятков процентов, a 244Pu — доли процента от содержания 242Pu. Весовые количества изотопно чистого 238Pu образуются при облучении нейтронами 237Np. Легкие изотопы П. с мас. ч. 232–237 обычно получают на циклотроне при облучении изотопов U α-частицами. Выделение и очистку изотопов П. осуществляют преим. экстракционными и сорбционными методами. Для пром. производства 239Pu используют пьюрекс-процесс, основанный на экстракции трибутилфосфатом в легком разбавителе. В первом цикле осуществляют совместную очистку Pu и U от продуктов деления, а затем их разделение. Во втором и третьем циклах П. подвергают дальнейшей очистке и концентрированию. Металлический П. получают восстановлением PuF4 или PuCl3 кальцием или магнием.
Применение. Изотоп 239Pu (наряду с U) используют в качестве ядерного топлива энергетич. реакторов, работающих на тепловых и особенно на быстрых нейтронах, а также при изготовлении ядерного оружия. Критич. масса для 239Pu в виде металла составляет 5,6 кг. Изотоп 239Pu является также исходным веществом для получения в ядерных реакторах трансплутониевых элементов. 238Pu применяют в малогабаритных ядерных источниках электрич. тока, используемых в космич. исследованиях, а также в стимуляторах сердечной деятельности человека.
Производство П. в капиталистич. странах составляет неск. десятков т в год.
П. высокотоксичен; ПДК для 239Pu в открытых водоемах и в воздухе рабочих помещений составляет соотв. 81,4 и 3,3∙10−5Бк/л.
Впервые П. получили и идентифицировали в 1940 Г. Cu-борг, Э. Макмиллан, Дж. Кеннеди и А. Валь.
Лит.: Плутоний. Справочник, под ред. О. Вика, пер. с англ., М., 1971; Громов Б. В., Савельева В. И., Шевченко В. Б., Химическая технология облученного ядерного топлива, М., 1983; Мефодьева M. П., Крот H. H., Соединения трансурановых элементов, М., 1987; Cleveland J. M., The chemistry of plutonium, N.Y., 1970.
Б. Ф. Мясоедов
Значения в других словарях
- Плутоний — (лат. Plutonium) Pu, искусственно полученный радиоактивный химический элемент, атомный номер 94; относится к актиноидам (См. Актиноиды). Открыт в 1940—41 американскими учёными Г. Сиборгом, Э. Макмилланом, Дж. Кеннеди... Большая советская энциклопедия
- плутоний — -я, м. Искусственно полученный химический элемент, обладающий радиоактивными свойствами (в ничтожных количествах содержится в урановых рудах). [По названию планеты Плутон] Малый академический словарь
- плутоний — Плуто́н/ий/. Морфемно-орфографический словарь
- плутоний — орф. плутоний, -я Орфографический словарь Лопатина
- ПЛУТОНИЙ — ПЛУТОНИЙ (символ Рu), серебристо-белый радиоактивный элемент, относится к АКТИНОИДАМ. Был впервые получен в 1940 г. в Калифорнийском университете в Беркли при бомбардировке УРАНА ядрами дейтерия (тяжелого водорода). Научно-технический словарь
- Плутоний — (Plutonium, Pu) химический элемент III группы периодической системы Д.И. Менделеева, относится к актиноидам; все изотопы П. радиоактивны; представляет опасность при попадании в организм. Медицинская энциклопедия
- плутоний — ПЛУТОНИЙ -я; м. Химический элемент (Pu), радиоактивный серебристо-белый металл, относящийся к актиноидам (получается искусственным путём; используется в ядерной энергетике как сырьё для получения ядерного топлива). Оружейный... Толковый словарь Кузнецова
- плутоний — [< соб.; см. Плутон] – хим. радиоактивный элемент (трансуран), символ Pu, порядковый номер 94, массовые числа 238 и 239; в природе не существует; получен искусственно в начале 40-х гг. Большой словарь иностранных слов
- ПЛУТОНИЙ — ПЛУТОНИЙ (лат. Plutonium) — Pu, химический элемент III группы периодической системы, атомный номер 94, атомная масса 244,0642, относится к актиноидам. Радиоактивен; наиболее устойчивый изотоп 244Pu (период полураспада 8,05.107 лет). Большой энциклопедический словарь
- плутоний — плутоний м. Радиоактивный химический элемент. Толковый словарь Ефремовой
- плутоний — ПЛУТОНИЙ, я, м. Серебристо-белый металл, изотоп к-рого является ядерным горючим. | прил. плутониевый, ая, ое. Толковый словарь Ожегова
