Ацетальдоксим
CH3.CH:N.OH, или
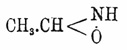
(см. Альдоксимы и Изонитрозосоединения) существует в форме двух изомеров (Дёнстен и Даймонд, 1892 г.), которые, однако, не соответствуют двум приведенным формулам, а являются, по-видимому, стабильной и лабильной формой 1-й формулы. Твердый α-А., плав. при 47° и при нагревании до 100° — 115° переходит в β-A. с темп. плавл. 13°. Последний, однако, неоднороден и представляет раствор стабильной формы (α) А. в жидкой лабильной (β) форме А. Наблюдение упругости пара жидкого и твердого (α) А. показали, что ниже 13° упругость пара жидкого А. выше упругости пара кристаллического А.; выше 13° — наоборот. Определение молекулярного веса по Раулю в уксуснокислом растворе дало для обеих форм величины, отвечающие формуле С2Н5NO. Темп. кипения А. — 114° — 115°. Продукты присоединения галоидалкилов к А. (Дёнстен и Гульдинг, 1897) имеют основные свойства; соли их при гидролизе распадаются на альдегид и β-алкилгидроксиламин, почему им придают строение 2-й из написанных
выше формул А., напр.:
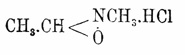
При окислении А. реактивом Каро [160 г персульфата калия растворяют в 180 г конц. H2SO4, прибавляют 400 г льда и 450 г поташа.] получается ацетгидроксамовая кисл. CH3.C(OH):N.OH, изонитроэтан и нитроэтан (Бамбергер, 1900). С хлористым ацетилом и уксусным ангидридом, по Дёнстену, как α-А., так и β-A. дают на холоду ацетильные производные, при нагревании — ацетонитрил.
П. Гр.
