Алкоголяты
I
продукты замещения гидроксильного водорода в алкоголях (см. это сл.).
II
(дополнение к статье)
продукты замещения водорода гидроксила спиртов металлами. А. по большей части суть твердые, кристаллические соединения, образующиеся при действии на спирты металлов, безводных окисей (бария, стронция и кальция) и едких щелочей. Третичные спирты не дают А. с окисями щелочноземельных металлов. Общая формула A.: Me(O.R)m. Действие К и Na на спирт впервые наблюдал Либих ("Ann.", 23,32). Слово "А." введено Кульманом (ib., 33, 101). Наиболее важный А. в практическом отношении — этилат натрия. При действии металлического Na на этиловый спирт при обыкновенной темп. происходит, с отделением 44,7 К, энергичная реакция — с выделением водорода:
C2H5OH + Na = C2H5ONa + H.
Этилат Na хорошо растворим в спирте и образует бесцветные, прозрачные кристаллы состава C2H5ONa + 2С2Н5(ОН), которые теряют кристаллизационный спирт при 170° — 200°, оставляя порошковатый А. Он применяется, как и А. бария и кальция, для обезвоживания спирта. Метиловый, пропиловый и амиловые А. по свойствам и способу получения подобны этиловому. Вода разлагает А. на исходный спирт и водную щелочь; при этом получается равновесная система. Растворы (спиртовые) А. постепенно краснеют на воздухе вследствие окисления их с образованием альдегида, дающего с избытком щелочи альдегидную смолу; вследствие этих свойств А. употребляются часто как энергичные восстановители. А. применяются для многих синтезов при введении спиртового остатка; в частности — для синтеза простых эфиров (см.), органических кислот (см.), также для получения кетонокислот и кетонов из натрацетоуксусного эфира (см. Ацетоуксусный эфир и Кетонокислоты), для отнятия галоидов и пр. В. Тищенко и С. Толкачев получили А. цинка со спиртами: этиловым, изоамиловым, изопропиловым и изобутиловым — действием цинкметила при — 20° в атмосфере азота на эти спирты. А. алюминия получены и исследованы большею частью В. Тищенко (1899). Амальгамированный алюминий при нагревании реагирует с одноатомными жирными и ароматическими (Гладстон и Трайб, 1880) спиртами и соединениями алкогольной функции. Во всех случаях образуются А.-кристаллические вещества, перегоняющиеся без разложения под уменьшенным давлением. Гладстон и Трайб получили А. алюминия Al(OC2H5)3 действием Al на спиртовой раствор йода. Большинство А. алюминия кристалличны и плавятся выше 100° и до 230°. Метилат алюминия не плавится. Все они растворимы в бензоле и толуоле и кристаллизуются из них. Вода энергично разлагает их с выделением спирта и Al(ОН)3. А. таллия Tl(OR)3 получены для метилового, этилового и амилового спиртов. Это самые тяжелые жидкости; уд. в. Tl(ОС2Н5)3 = 3,685. К А. же относятся и промежуточный соединения Mg и Zn с органическими остатками; такие соединения получаются при синтезах: а) вторичных спиртов по Вагнеру, b) третичных спиртов по А. Бутлерову, А. Зайцеву и Гриньяру, с) кетонов по Д. Павлову и А. Зайцеву, d) вторичных β-оксикислот по С. Реформатскому. В этих случаях образуются в средней фазе реакции соединения типа
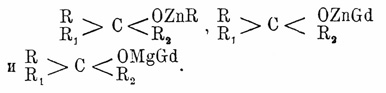
Эти — алкил-Zn-А., галоид-Zn-А. и галоид-Mg-A. — некристалличные, вязкие массы, водой разлагаемые на спирт (кетон), галоидоводородную кислоту и гидроокись Mg или Zn. В большинстве работ эти тела не были ни выделены, ни анализированы. Только в работах Даина (1896) приведены анализы нескольких галоид-Zn-A.; результаты этих анализов отвечают вышеприведенной формуле.
П. Григорович.
Значения в других словарях
- алкоголяты — АЛКОГОЛЯТЫ продукты замещения атома Н в молекуле спирта на металл (М). Алкоголята одноатомных спиртов. Их общая формула M(OR)n, где n-степень окисления металла. А. щелочных, щел.-зем. металлов, Т1(1) и первичных спиртов-ионные соед. Химическая энциклопедия
- АЛКОГОЛЯТЫ — АЛКОГОЛЯТЫ — продукты замещения в спиртах атома водорода гидроксильной группы металлом, напр. RONa (R = CH3, C2H5 или др. углеводородный радикал). Алкоголяты — твердые, бесцветные, легко гидролизующиеся продукты; применяются в органическом синтезе. Большой энциклопедический словарь
