АЗОТА ФОСФОРА СЕМЕЙСТВО
ПОДГРУППА VA. СЕМЕЙСТВО АЗОТА ФОСФОРА
Тенденция изменения свойств от неметаллических до металлических, которая выявлена в подгруппах IIIA и IVA, характерна и для этой подгруппы. Переход к металличности (хотя и нерезкий) начинается с мышьяка, у которого в отличие от фосфора уже заполнен 18 электронами электронный слой, расположенный под валентными электронами (табл. 6). Однако ни As, ни Sb не имеют типичных металлических свойств, как можно было бы ожидать у элементов с такой электронной структурой. Полностью металлическая природа элемента проявляется в этой подгруппе только у висмута, хотя и его металлические свойства не ярко выражены, особенно по проводимости.
 Таблица 6. АЗОТ, ФОСФОР, МЫШЬЯК, СУРЬМА, ВИСМУТ
Таблица 6. АЗОТ, ФОСФОР, МЫШЬЯК, СУРЬМА, ВИСМУТ
АЗОТ
Химический элемент азот, N, седьмой элемент периодической таблицы элементов и первый элемент подгруппы VA. Наиболее распространенная форма азота изотоп 147N, в ядре которого содержится семь протонов и семь нейтронов. Общее содержание этого изотопа азота в природе равно 99,635%, остальное количество (0,365%) составляет изотоп 157N, содержащий в ядре 7 протонов и восемь нейтронов; атомная масса азота соответственно равна 14,008.
Около 79% (об.) азота в атмосфере состоит из двухатомных молекул N2. В природе существует примерный баланс азота: с одной стороны, азот из атмосферы усваивается бактериями и расходуется в химических и электрических (молния) процессах, а с другой, азот возвращается в атмосферу при разложении азотсодержащих веществ. Азот бесцветный газ. Он имеет ничтожную растворимость в воде, всего 23 мл/л при 0° C и 1 атм.
Азот выделяют из воздуха сжижением. При этом вначале азот и кислород отделяются от CO2, паров H2O и некоторых примесей химическими и механическими методами (адсорбция, охлаждение, фильтрация). При медленном нагревании жидкий воздух подвергается фракционной перегонке и при этом азот отделяется от остающегося жидкого кислорода. Благородные газы (He, Ne, Ar, Kr, Xe) выкипают раньше, чем азот, и, если необходимо, их сжижают вместе.
См. также ВОЗДУХ.
Химическая связь в молекуле азота очень прочная, поэтому азот совершенно инертен при низких температурах. В условиях электрического разряда или электрической дуги азот соединяется с кислородом, образуя несколько оксидов, в основном оксид азота(II) NO и оксид азота(IV) NO2. Известны и другие оксиды азота, их получают по следующим реакциям:
1) оксид азота(I) N2O 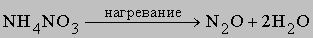
2) оксид азота(III) N2O3 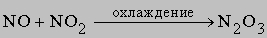
3) димер оксида азота(IV) N2O4 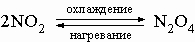
4) оксид азота(V) N2O5 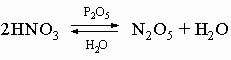
Аммиак. При высоких температуре и давлении азот соединяется с водородом на поверхности платинового катализатора, образуя важное соединение аммиак:
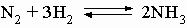
Этот процесс (в промышленности применяют метод Габера или метод Клода) относится к процессам фиксации азота, так как образующийся из химически инертного молекулярного атмосферного азота аммиак способен к участию в химических реакциях и образованию других соединений азота и может использоваться для удобрения почвы. Количества азота в атмосфере, находящегося над 1 кв. километром земной поверхности, теоретически достаточно для получения 7 млн. т аммиака. Среди других соединений азота, пригодных в качестве удобрений для почвы и получаемых из аммиака, известны нитрат аммония NH4NO3, получаемый по реакции аммиака с азотной кислотой, фосфат аммония (NH4)3PO4, получаемый по реакции аммиака с фосфорной кислотой H3PO4, и мочевина, образующаяся из аммиака и CO2. Из аммиака также можно получать азотную кислоту HNO3 (окислением аммиака на воздухе с поглощением оксидов азота водой), гидразин NH2NH2 (по реакции аммиака с гипохлоритом натрия NaOCl). Гидразин и некоторые его производные используются в качестве ракетного топлива. Аммиак, гидразин и азотистоводородная кислота HN3 это гидриды азота. Аммиак и вода имеют ряд сходных свойств, позволяющих использовать аммиак как растворитель для некоторых неорганических веществ. Для сравнения приведены два процесса автоионизации аммиака и воды:
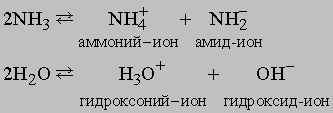
Нитриды. При высокой температуре азот реагирует с некоторыми металлами, образуя соединения класса нитридов. Например,
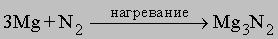
Нитрид магния гидролизуется:
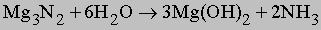
Другие азотсодержащие соединения. Азот также реагирует с карбидом кальция CaC2 при высокой температуре с образованием цианамида кальция CaCN2. При гидролизе цианамида образуется аммиак:
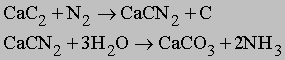
Нитрат натрия NaNO3, известный как чилийская селитра, добывается в больших количествах в Чили. Он используется как сырье для производства азотной кислоты по следующей реакции:
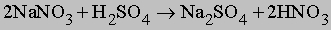
Азот, образуя связь с углеродом, входит в состав многих природных органических соединений, например аминокислот RCHNH2COOH, аминов RNH2 и амидов RCONH2
(см. также АЗОТ).
ФОСФОР, МЫШЬЯК, СУРЬМА, ВИСМУТ
Получение. Некоторые элементы этой подгруппы встречаются в свободном состоянии и известны с древних времен; они относительно легко получаются из их оксидов или сульфидов. Сурьма иногда встречается в свободном состоянии, а другие элементы в основном в виде оксидов или сульфидов и реже в соединениях с другими неметаллами (см. табл. 6). Фосфор занимает 12-е место по распространенности элементов в природе. Он входит в состав многих горных пород и содержится в живых организмах (в костях, зубах и т.д.). Фосфор впервые был выделен из человеческой мочи. Химические связи PO в фосфат-ионе PO43одни из наиболее прочных, поэтому для получения свободного фосфора требуются большие затраты энергии. В промышленности фосфор получают при прокаливании смеси фосфата кальция, оксида кремния(IV) (песка) и кокса при высокой температуре в соответствии с реакцией Ca3(PO4)2 + 3SiO2 + 5C (r) 3CaSiO3 + 0,5P4 + 5CO
Фосфор возгоняют и плавят, в результате образуется белая модификация фосфора, которую хранят под слоем холодной воды (с холодной водой он не реагирует). Другие элементы этого семейства получают из оксидов восстановлением углеродом.
Аллотропия. Все элементы подгруппы, встречающиеся в свободном состоянии, имеют аллотропные модификации (состояния с различной кристаллической или атомной структурой вещества). С ростом атомного номера многообразие и сложность модификаций постепенно уменьшаются. У фосфора известны более 10 аллотропических модификаций, из которых наиболее важные белый, красный и черный фосфор; взаимопревращения между ними представлены следующей схемой:
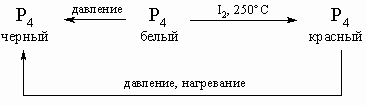
Отметим некоторые различия в свойствах. Белая модификация как более реакционноспособная активно реагирует с молекулярным кислородом, поэтому белый фосфор применяют в устройствах для воспламенения. Он растворим в CS2, но нерастворим в холодной воде. Белый фосфор очень ядовит, вызывает сильные ожоги и работа с ним требует особой осторожности. Белый фосфор имеет тетраэдрическое строение, компактность такой молекулы объясняет высокую летучесть фосфора. Ковалентные связи в тетраэдре не очень прочные, чем и объясняется образование оксидов, некоторых сульфидов и других соединений. Красная модификация фосфора значительно менее реакционноспособна, чем белая; красный фосфор нерастворим в любых растворителях (как и черный), воде и не так ядовит. Структура ближе к форме связанных треугольников, чем к тетраэдру. Соединения, образуемые из белого или красного фосфора, идентичны. Черный фосфор обладает металличностью некоторой проводимостью и блеском. Мышьяк образует аллотропные модификации, частично подобные модификациям фосфора. Сурьма существенно отличается от фосфора и мышьяка, а висмут демонстрирует многие свойства, характерные для металлических структур.
Применение. Фосфор применяется в основном для химических синтезов, другие элементы находят применение в технологии сплавов. Сурьму добавляют к свинцу для увеличения твердости; сплавы, содержащие до 12% (масс.) сурьмы, применяют в производстве аккумуляторов. Сплавы свинца с висмутом, как и с другими элементами этого семейства, используют в производстве легкоплавких материалов, например, сплава Вуда (Pb, Bi, Sn, Cd). Соединения мышьяка являются инсектицидами. Фосфид натрия (Na3P), синтезируемый из элементов, применяют для изготовления морских сигнальных огней. При реакции фосфидов с водой образуется ядовитое вещество фосфин PH3, запах которого часто обнаруживается при реакции цинка или железа с HCl в водной среде, так как фосфиды могут присутствовать как примеси.
Реакции. Для всех элементов подгруппы характерно общее строение внешнего электронного слоя ns2np3, однако трудно достаточно точно предсказать химические свойства элементов. Азот проявляет все степени окисления от III до V, у фосфора (см. табл. 6) реализуются почти все степени окисления от III до V. Разнообразие степеней окисления уменьшается с ростом массы элемента; висмут в степени окисления V неустойчив, легко восстанавливается до степени окисления III, основной для висмута. В особых условиях все же можно получить соединения этих элементов с необычными степенями окисления. Азот может принимать только 8 электронов от 4 доноров, а остальные элементы являются акцепторами 10, 12 и более электронов (от 5, 6 и более доноров или лигандов). Однако в этом у них мало общего, определенные сходства и различия более четко проявляются при рассмотрении соединений этих элементов.
Оксиды. Кроме азота, все элементы подгруппы VA активно реагируют с кислородом, фосфор образует оксид P(V) P4O10, а другие, более тяжелые элементы только оксиды в степени окисления III. Более легкие элементы образуют оксиды тетраэдрического строения. Для мышьяка и сурьмы кроме As4O6 и Sb4O6 известны также As2O5, Sb2O4 и Sb2O5, но структуры их недостаточно изучены. As2O5 и Sb2O5 получают дегидратацией соответствующих кислот, H3AsO4 и HSb(OH)6. Sb2O4 образуется при прокаливании Sb4O6 или Sb2O5 на воздухе.
Кислоты. Фосфорные кислоты легко получаются при растворении оксидов фосфора. Схема образования многообразных кислот и солей фосфора приведена ниже:
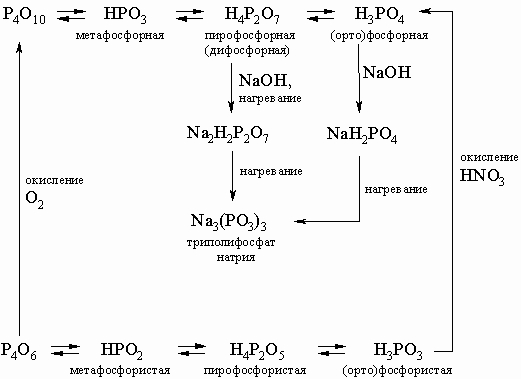
В этой схеме отсутствует фосфорноватистая (гипофосфористая) кислота H3PO2 (сильный восстановитель, образуется в небольших количествах при реакции белого фосфора с кипящей водой), а также фосфорноватая (гипофосфорная) кислота H4P2O6 (получается по реакции красного фосфора с NaOCl в кислой среде). Ниже приводятся структурные формулы некоторых кислот фосфора:
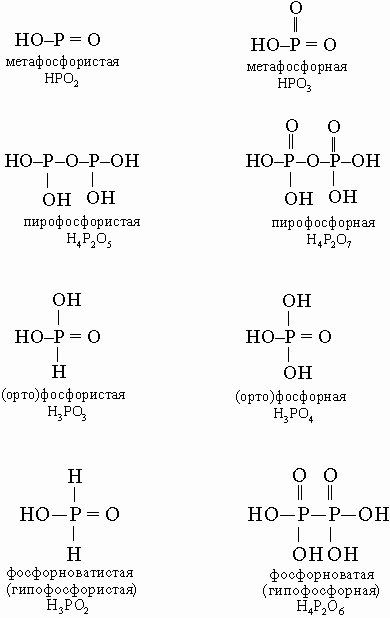
Кислоты других элементов, проявляющих больше металлических свойств, отчасти сходны по форме, однако с ростом молекулярной массы уменьшается способность атомов образовывать прочные двойные связи (такие, как P=O). Поэтому образуются одиночные OH-группы, например, состав ортосурьмяной кислоты HSb(OH)6, а не H3SbO4.
Фосфорные кислоты и их соли находят многочисленные применения в промышленности. Средние фосфаты и полифосфаты Na3P3O6 и более сложного состава применяют в многотоннажном производстве моющих средств, в процессах умягчения и очистки воды. Фосфат кальция CaH4P2O8 применяют при изготовлении муки и в качестве заменителя дрожжей. Ca3P2O8 применяют в производстве зубных порошков и паст, пирофосфаты расходуются для изготовления буровых растворов, в стекольном производстве, в водоподготовке, для очистки металлов и антикоррозионной защиты. Тысячи тонн фосфатов используют как удобрение в сельском хозяйстве: практически нерастворимый Ca3(PO4)2 переводят в растворимую форму Ca(H2PO4)2 добавлением серной или азотной кислоты, причем при использовании азотной кислоты в почву вводится помимо фосфора также и азот в усвояемой форме.
Сульфиды. Сера реагирует непосредственно со всеми элементами подгруппы VA, с фосфором образуются P4S3, P4S7, P4S5, а с P4O10 образуется оксосульфид P4O6S2. P4S3 используют для производства легковоспламеняющихся (небезопасных) спичек, а для изготовления безопасных спичек применяют смесь P4S3 и Sb2S3: сульфид сурьмы входит в состав спичечной головки вместе с окислителем KClO3, а смесь P4S3 и Sb2S3 с песком покрывает боковую поверхность спичечного коробка. Существование As2S5 и Sb2S5 не установлено надежно, а образующийся Bi2S5 самопроизвольно разлагается на S и Bi2S3.
Гидриды. Изменения свойств гидридов элементов этой подгруппы вполне предсказуемы. Аммиак NH3 стабильное соединение со слабыми основными свойствами (донор электронной пары), а в жидком состоянии слабый донор H+. Устойчивость гидридов в подгруппе убывает с увеличением атомного номера, ослабевают донорные способности электронной пары, но возрастает способность к отщеплению водорода; получить BiH3 не просто.
Галогениды. В ряду галогенидов систематичности свойств не наблюдается. Только BiF3 является ионным соединением, что связано с максимальной металличностью висмута в этой подгруппе элементов. Все элементы образуют галогениды состава MX3, а фосфор также и P2Cl4 и P2I4. Среди галогенидов MX5 не установлено образование AsCl5, а висмут образует только BiF5, легко разлагающийся на F2 и BiF3 (поэтому BiF5 хороший фторирующий агент). Фосфор несмотря на малый радиус способен образовывать PCl5 и даже PBr5. Устойчивость этих галогенидов фосфора объясняется слабым окислительным действием P(V) в отличие от Bi(V), а также особенностями строения галогенида (в случае хлорида PCl4+ PCl6). Галогениды MX3 несмотря на наличие неподеленной электронной пары не образуют аддуктов по донорно-акцепторному механизму. Все галогениды энергично реагируют с водой (гидролиз), например:
PCl3 + 3H2O -> P(OH)3 + 3HCl
Однако гидролиз галогенидов азота(III) протекает иначе, чем у галогенидов остальных элементов этой группы.
Взаимодействие с кислотами. Элементы этой группы по-разному реагируют с кислотами. Ни один из них самопроизвольно не взаимодействует с HCl с выделением водорода. Кислоты-окислители, такие, как HNO3, реагируют с As и Sb; сурьма при длительной обработке образует Sb2O4. Висмут растворяется в азотной кислоте, образуя нитрат Bi(NO3)3. Сульфаты мышьяка, сурьмы и висмута можно получать при растворении соответствующих оксидов в серной кислоте.
См. также ФОСФОР; МЫШЬЯК; СПИЧКИ.
