ХИМИЧЕСКИЕ СВЯЗИ, ФОРМУЛЫ И УРАВНЕНИЯ
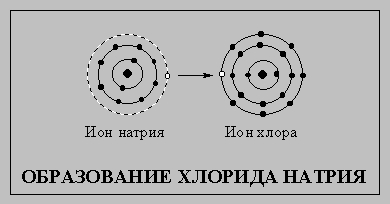
Элементы, не обладающие стабильной электронной конфигурацией инертных газов, стремятся приобрести ее, вступая в химические реакции. Атомы, которым до стабильной конфигурации не хватает незначительного числа электронов или, напротив, у которых имеется небольшой их избыток, обычно образуют электрически заряженные частицы — ионы. Положительно заряженные ионы (образующиеся при потере электронов) называют катионами, отрицательно заряженные ионы (образующиеся при приобретении электронов) — анионами. Заряд ионов редко превышает 3, т.е. атомы редко теряют или приобретают более трех электронов. Атом натрия (см. схему), соединяясь с атомом хлора, теряет один наружный электрон и превращается в катион, а атом хлора приобретает этот электрон и становится анионом. Их внешние электронные оболочки становятся заполненными и содержат по восемь электронов. Катион и анион притягиваются, образуя хлорид натрия.
Электроны внешней оболочки, участвующие в образовании химических связей, называют валентными. (Валентность элемента равна числу связей, которые он способен образовать.) Некоторые элементы и их валентные электроны перечислены в приведенной выше таблице. В ней также указаны атомные номера элементов и наиболее распространенные ионы. Элементы, имеющие одинаковую электронную конфигурацию внешних оболочек и обладающие сходными физическими и химическими свойствами, объединены в периодической системе элементов в группы от I до VIII, причем номер группы совпадает с числом валентных электронов. Периодическая система элементов помогает понять, чем объясняется сходство элементов, принадлежащих данной группе, и почему эти элементы все-таки отличаются друг от друга. Открытие периодического закона и публикация периодической системы русским химиком Д.И.Менделеевым в 1869 явились важнейшим этапом в систематизации свойств известных и предсказании еще неоткрытых химических элементов.
См. также ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ.
Ионная связь. Противоположно заряженные ионы притягиваются друг к другу и сближаются, но лишь до определенного предела. Когда расстояние между ионами становится слишком мало, их электронные облака начинают отталкиваться, и дальнейшее сближение становится невозможно. Таким образом, есть определенное расстояние, на котором ионная пара наиболее стабильна. Его называют длиной ионной связи. Пространственное расположение заряженных частиц в веществе, имеющем ионный характер состояния, строго упорядоченно. В качестве примера ионных соединений можно привести обычную поваренную соль NaCl, в которой ион натрия Na+ связан с ионом хлора Cl-, или хлорид кальция CaCl2 с соотношением между ионами кальция Са2+ и хлорид-ионами Cl- 1:2. Как NaCl, так и CaCl2 электрически нейтральны.
Ковалентная связь. Другой распространенный тип связи — ковалентная связь — возникает, когда два атома обобществляют одну (или более) пару электронов. При образовании ковалентной связи атомы удерживаются вместе электростатическим притяжением ядер к общей электронной паре, в отличие от ионной связи, в основе которой лежит электростатическое притяжение между самими ионами. Ковалентные связи обычно образуются в тех случаях, когда ядра атомов притягивают электроны примерно с одинаковой силой. Такая связь существует, например, в молекуле хлора (см. схему). Есть удобное правило для определения типа связи между атомами двух элементов: если один элемент находится в левой части периодической таблицы, а другой — в правой, то связь между ними будет ионной (см. элементы, перечисленные в приведенной выше таблице).

Если валентные электроны обозначить точками, то различие между двумя типами связи станет более наглядным:

Соединения типа LiF, BeO или BeF2 ионные. Соединения, молекулы которых состоят из элементов — соседей по периодической таблице, как правило, ковалентные (CO2, CF4, NO2, N2, O2, F2). Правда, некоторые металлы образуют как ионные, так и ковалентные соединения. Два атома могут иметь две или даже три общие электронные пары, образуя двойную или тройную связь:

Полярная связь. Между чисто ковалентной (Cl2) и чисто ионной (LiF) связями есть еще одна, промежуточная. Она образуется, когда разные атомы притягивают общую электронную пару с неодинаковой силой. Способность атома оттягивать на себя электроны, участвующие в образовании химической связи, называется электроотрицательностью. Между атомами с существенно разной электроотрицательностью образуется чисто ионная связь; по мере уменьшения различий в электроотрицательности связь приобретает ковалентную "компоненту" и, наконец, становится чисто ковалентной. Электроотрицательность атомов хлора в молекуле Cl2 одинакова, поэтому связь между ними ковалентная. Связь Н-О в молекуле воды имеет в некоторой степени ионный характер, поскольку кислород более электроотрицателен, чем водород, и оттягивает на себя электронную пару. Такие связи называют полярными, причем полярность связи возрастает по мере увеличения ее ионного характера.
 ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ (шкала Полинга)
ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ (шкала Полинга)
Степень окисления. Полярность связи Н-О иллюстрирует концепцию окисления (полной или частичной отдачи электронов), весьма полезную для наглядной иллюстрации картины распределения обобществленных электронов для механизма некоторых химических реакций. Атом кислорода сильнее притягивает общую электронную пару, поэтому можно сказать, что он как бы приобретает один лишний электрон за счет атома водорода. Обычно атом кислорода образует две связи, как в молекуле Н2О, следовательно, притягивает к себе два электрона и обладает степенью окисления -2. Поскольку атом водорода как бы теряет один электрон, его степень окисления +1. Степень окисления кислорода отличается от -2 в соединениях, называемых пероксидами, например в пероксиде водорода Н2О2. Здесь каждый атом кислорода делит один электрон с другим атомом и принимает от атома водорода один электрон. Поэтому степень окисления кислорода в пероксиде водорода -1. Степень окисления отдельного атома или молекулы (Mg, Cl2, O2) равна нулю. В нейтральном соединении сумма степеней окисления всех атомов равна нулю, в заряженном — суммарному заряду. Эти правила позволяют вычислить степень окисления атома в каждом конкретном соединении. В молекуле SO2 два атома кислорода в сумме дают степень окисления -4, а поскольку суммарная степень окисления молекулы должна равняться нулю, то степень окисления S равна +4. В анионе SO42- степень окисления серы +6, а в H2S она равна -2. Более электроотрицательному элементу приписывают знак минус.
Формулы. Поскольку количества атомов в молекуле относятся между собой как небольшие целые числа, состав молекулы можно представить, используя символы химических элементов и цифры, показывающие число атомов каждого элемента. Так, молекула воды, которая состоит из двух атомов водорода и одного атома кислорода, имеет формулу Н2О; пероксид водорода, в молекуле которого по два атома каждого элемента, — Н2О2. Формула оксида углерода — СО, диоксида — СО2, поскольку в молекулах этих соединений содержатся соответственно один атом углерода и один атом кислорода или один атом углерода и два атома кислорода. Формула FeSO4 отвечает сульфату железа(II); в молекуле этого соединения по одному атому железа и серы и четыре атома кислорода. Совокупность атомов, образующих определенную группу, обычно характеризуют одним словом. Например, SO42- — это сульфатная группа, она входит в состав таких соединений, как сульфат алюминия Al2(SO4)3 и сульфат железа(III) Fe2(SO4)3. Другой пример — нитратная группа NO3-, входящая в состав нитрата аммония NH4NO3.
Ионы изображают, добавляя к символу элемента или группы знак "+" или "-". Например, Na+ — это ион натрия, Cl- — хлорид-ион, SO42- — сульфат-ион, Fe2+ — ион железа(II), Fe3+ — ион железа(III). Последние два иона получены из атома железа удалением двух и трех электронов соответственно. Структурные формулы наглядно показывают, из каких атомов состоят молекулы и какими связями они соединены; общие электронные пары или ковалентные связи обозначают черточками. В качестве примера рассмотрим этиловый спирт. Его обычная химическая формула С2Н5ОН. Такую же формулу имеет другое соединение — диметиловый эфир, и различие между этими соединениями можно увидеть, только записав их структурные формулы:
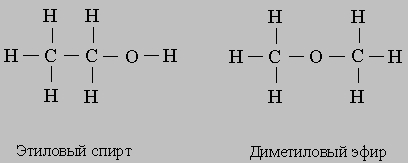
Конечно, такие формулы занимают больше места, чем обычные (CH3 -CH2 -OH и СН3 -О-СН3 или С2Н5ОН и СН3ОСН3). Поэтому в структурных формулах циклических соединений углерода химические символы часто опускают, изображая только кольцо из связей между атомами углерода. Ниже представлены полная структурная формула бензола (слева) и бензольное кольцо (справа):
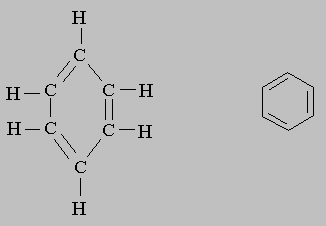
Уравнения. Химические реакции можно представить в виде уравнений; при этом химические формулы реагентов находятся в левой части, продуктов реакции — в правой, а между ними стоит знак равенства (=), однонаправленная ((r)) или двунаправленная (") стрелка или двойные стрелки ( или ). Знак равенства означает, что из данных веществ образуются другие, а двунаправленная стрелка или двойные стрелки указывают, что реакция может протекать в обоих направлениях и между реагентами и продуктами устанавливается динамическое равновесие. Одинарная стрелка иногда заменяет знак равенства, но чаще означает, что реакция идет только в одном направлении. Таким образом, уравнение 2Cl Cl2 говорит о том, что два атома хлора, соединяясь, образуют молекулу и реакция может протекать в обратном направлении. На эту реакцию, как и на многие другие, влияют условия, в которых ее проводят, например температура. В реакции 2Cl Cl2 молекула хлора образуется при комнатной температуре, а атомарный хлор — при более высокой. Иногда эти условия указывают над стрелкой. Так, вместо приведенной выше реакции можно записать:

Если реакционную смесь нагревают, то над стрелкой иногда ставят греческую букву дельта, D. Физическое состояние реагентов и продуктов реакции указывают буквами г., ж., тв., водн., что означает соответственно газ, жидкость, твердое тело, водный раствор. Таким образом, уравнение
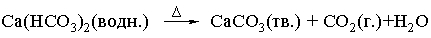
показывает, что при нагревании водного раствора бикарбоната кальция образуются твердый осадок карбоната кальция, газообразный диоксид углерода и вода (в виде паров или жидкости в зависимости от температуры).
См. также ХИМИЧЕСКИЕ УРАВНЕНИЯ. Сбалансированные уравнения. Реакцию между серной кислотой и гидроксидом натрия с образованием сульфата натрия и воды можно записать в виде NaOH + H2SO4 = H2O + Na2SO4. В действительности это уравнение не точное, поскольку число атомов одного и того же элемента в обоих частях равенства должно быть одинаковым, здесь же в левой части один атом натрия, а справа — два. Чтобы уравнять число атомов Na, перед NaOH нужно поставить коэффициент 2; аналогичным образом следует уравнять число атомов водорода и кислорода. В результате уравнение примет вид
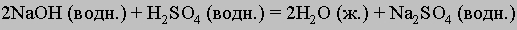
Подобные процедуры необходимо проводить до того, как уравнение будет использоваться для каких-либо вычислений.
Ионные уравнения. Многие вещества в растворе диссоциируют на ионы, которые могут вступать в химические реакции. В качестве примера рассмотрим приведенную выше реакцию между растворенными в воде гидроксидом натрия и серной кислотой. Реакция, записанная в ионной форме, будет иметь вид
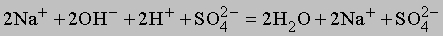
Ионизация воды здесь не показана. Отметим, что число ионов натрия и сульфат-ионов не изменяется, взаимодействуют только гидроксильные ионы и ионы водорода, поэтому суммарную реакцию можно записать в виде
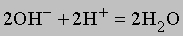
или еще проще
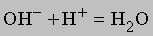
Массовые соотношения. Зная химическую формулу соединения и атомные массы, можно найти соотношения между массами элементов, входящих в состав соединения. Рассмотрим соединение Fe2O3 — оксид железа(III), обычную ржавчину. Найдем в периодической таблице атомные массы элементов и сложим их:
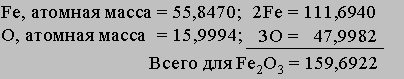
Доля железа в оксиде железа(III) составляет 111,6940/159,6922 = 0,6994, или 69,94%. 159,6922 — это мол. масса оксида железа(III).
См. также МОЛЕКУЛЯРНАЯ МАССА. Распространив этот принцип на химические уравнения, можно рассчитать, какое количество каждого из реагентов необходимо взять для того, чтобы по завершении реакции ни один из них не остался неизрасходованным, а также оценить, сколько разных продуктов образуется в ходе реакции. Так, в реакции окисления железа
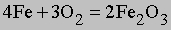
4*55,8470 = 223,3880 г железа взаимодействуют с 6Ч15,9994 = 95,9964 г кислорода, образуя 319,3844 г оксида железа(III). Зная количество железа, всегда можно рассчитать массу образовавшегося из него оксида.
Объемы газов и химические реакции. При постоянных давлении и температуре объемы реагирующих друг с другом газов, а также объемы газообразных продуктов реакции относятся как небольшие целые числа (закон Гей-Люссака). Эти отношения равны коэффициентам соответствующего химического уравнения. Рассмотрим, например, горение метана СН4, основного компонента природного газа. Как следует из уравнения реакции СН4 + 2О2 = СО2 + 2Н2О, для поддержания горения одного объема метана требуются два объема кислорода, а в результате образуются один объем диоксида углерода и два объема воды. Все объемы, конечно, приведены к одинаковым температуре и давлению.
