ХИМИЯ ОРГАНИЧЕСКАЯ. РЕАКЦИИ СОЕДИНЕНИЙ
В этом разделе кратко представлены примеры реакций и соединений из различных классов органических веществ.
Классификация органических соединений. В классификации, использованной здесь, функциональные группы расположены в порядке возрастания "степени окисления" углерода, хотя приписывать углероду степень окисления на основании полярности углеродных связей — несколько условная процедура, поскольку углерод остается четырехковалентным и не приобретает и не теряет электроны полностью. Углерод-водородные или углерод-углеродные связи почти неполярны, и степень окисления углерода в углеводородах можно приравнять нулю. Каждая простая ковалентная связь с более электроотрицательным элементом, например азотом, серой, кислородом или галогеном, формально увеличивает степень окисления на единицу, тогда как каждая связь с более электроположительным элементом понижает ее на единицу (табл. 7).
 Таблица 7. СТЕПЕНЬ ОКИСЛЕНИЯ УГЛЕРОДА В ОСНОВНЫХ КЛАССАХ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Таблица 7. СТЕПЕНЬ ОКИСЛЕНИЯ УГЛЕРОДА В ОСНОВНЫХ КЛАССАХ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Такая классификация оправдана тем, что реакции веществ, принадлежащих к данному "окислительному состоянию", изменяются не слишком сильно по мере увеличения числа углеродных атомов. Характерное поведение реагирующего атома или группы в молекуле остается обычно неизменным. Так, реакции спиртов CH3OH, CH3CH2OH и CH3CH2CH2OH можно рассматривать как практически одинаковые. Более того, можно отметить, что различные соединения с одинаковой степенью окисления углерода могут быть получены друг из друга простыми реакциями замещения, например: CH3OH + HBr -> CH3Br + H2O, тогда как переход от одной степени окисления к другой требует окисления [[O]] или восстановления [[H]], и, таким образом, использования окислителя или восстановителя:
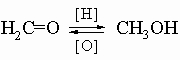
Обычно часть молекулы, присоединенная к данной функции, не изменяется при изменении функции в результате замещения или окисления-восстановления. Эта неизменная часть, часто называемая радикалом, обозначается символом R (для алифатических или алициклических систем) или Ar (для систем, в которых функция присоединена к ароматическому ядру). Так, написанные выше реакции можно было бы представить в общем виде следующим образом:
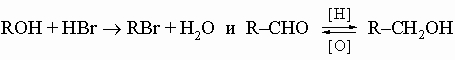
Хотя общий принцип неизменности радикалов в органических реакциях очень помог развитию и систематизации органической химии, его, как и все обобщения, нужно применять с осторожностью. Исключения встречаются, например, когда R содержит другие функции, которые также могут быть модифицированы применяемыми реагентами, или когда процесс замещения сопровождается "молекулярной перегруппировкой", например, RX + Y -> R'Y + X, как в
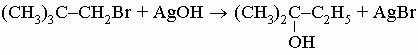
Способность предсказывать такие отклонения, а также умение подавить их или использовать для достижения цели — одно из главных качеств хорошего химика-органика. Таблица 8 показывает взаимоотношения типов органических соединений и порядок обсуждения их реакций в разд. IV
 Таблица 8. ТИПЫ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Таблица 8. ТИПЫ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
