ХИМИЯ ПОВЕРХНОСТНЫХ ЯВЛЕНИЙ
Изучает химические силы, действующие на поверхности. В общем случае химия поверхности рассматривает свойства трех состояний вещества — твердого (Т), жидкого (Ж) и газообразного (Г) и дает описание вещества как фазовой системы. Однако если два различных состояния (две фазы) мгновенно смешать, получается система, для описания которой требуется знание не только характеристик массы или объема составляющих фаз, но и свойств пограничной области между ними, т.е. границы раздела фаз, а этот вопрос является предметом изучения науки о поверхностных явлениях, которая включает в себя физику и химию поверхности. Так как граница раздела играет определяющую роль в коллоидных системах, химия поверхностных явлений для этих систем имеет важнейшее значение, но особенно она важна и более широко распространена в биологии, ведь живая клетка, например, содержит не только внешнюю мембранную систему, но и много других границ раздела между ее компонентами.
См. также ХИМИЯ КОЛЛОИДНАЯ. Обычно существует несколько типов границ раздела: Т/Т, Т/Ж, Ж/Ж, Т/Г, Ж/Г. Не реализуется только граница раздела Г/Г, так как газы полностью смешиваются друг с другом. Твердые тела или жидкости могут образовывать стабильные границы раздела. Граница раздела Т/Т хорошо известна в геологических образованиях типа гранита, а также в металлургии. Граница раздела Ж/Ж существует в эмульсиях, которые приобретают все возрастающее значение в приготовлении пищевых продуктов и медицинских препаратов. Граница раздела Т/Ж имеет фундаментальное значение для стабильности многих коллоидных дисперсных систем, универсальный характер которых делает ее важной в более широком смысле. Так, знание свойств границы раздела Т/Ж, а также Т/Г имеет решающее значение для развития представлений о гетерогенном катализе (см. ниже). Примером практического использования химии поверхностных явлений на границе раздела Т/Г является каталитический нейтрализатор выхлопных газов автомобильного двигателя. Граница раздела Ж/Г имеет важное практическое значение вследствие ее широкого распространения, а также теоретическое значение, поскольку ее рассмотрение на молекулярном уровне служит моделью развития представлений и о других границах раздела. Силы, действующие на поверхности, т.е. на границе раздела (поверхностные силы), по своей природе не отличаются от сил, действующих в объеме фаз. Они могут меняться в широком диапазоне — от очень слабых, вандерваальсовых (сил межмолекулярного взаимодействия) до очень сильных ковалентных связей, характерных для стабильных химических соединений. Слабые силы, по-видимому, обусловлены электростатическими эффектами, которые возникают под влиянием электронных оболочек, окружающих атомы. Слабые силы, часто называемые дисперсионными, характерны для углеводородов и многих легкокипящих веществ, но, вероятно, в той или иной степени дают вклад во все типы связей. Слабые связи проявляются в полярных веществах типа постоянных электрических диполей, между которыми возникают взаимодействия, приводящие к упорядочению диполей и увеличению прочности связей между ними. Водородные связи в воде, имеющие именно такую природу, ответственны за ее аномальные свойства (если сравнить с другими аналогичными молекулами, например H2S). Подобные связи водород образует с другими (электроотрицательными) элементами — азотом, фтором и т.д.; особенно важные примеры дают гелеподобные структуры белков и нуклеиновых кислот. В некоторых веществах происходит настолько значительное разделение электрических зарядов, что образуются ионы (а не нейтральные атомы), и электростатические силы (электростатические связи) обеспечивают образование структуры высокой стабильности. Так, в молекуле обычной соли (хлорид натрия, NaCl) ионы натрия и хлора структурно эквивалентны — один ион натрия (Na+) окружен хлорид-ионами (Cl-), находящимися на одинаковом расстоянии, и, наоборот, один хлорид-ион окружен ионами натрия, находящимися на одинаковом расстоянии. Это вещество состоит не из отдельных молекул NaCl; скорее, кристалл соли является одной гигантской полимерной молекулой. Многие неорганические материалы имеют структуру подобного типа. Другой тип очень стабильной структуры содержит ковалентные связи. (В ковалентной связи два атома передают электроны в общее пользование, при этом не происходит разделения электрических зарядов или оно крайне мало.) Такая структура типична для алмаза. Алмаз — это чистый углерод, в котором каждый нейтральный атом углерода ковалентно связан с четырьмя другими, находящимися в вершинах тетраэдра, расстояния между которыми одинаковы. Каждый из этих атомов таким же образом связан с четырьмя другими атомами углерода, и в целом подобная структура существует на протяжении всего кристалла алмаза. Как и в случае электростатически связанных кристаллов, таких, как NaCl, нельзя говорить о молекулах, включенных в структуру алмаза, — скорее, алмаз — это одна огромная молекула Cn, содержащая только один тип атомов. Рассмотренные выше силы — это силы притяжения, которые приводят к образованию молекул или молекулярных агрегатов. Однако существуют также силы отталкивания, возникающие вследствие взаимного отталкивания электронных оболочек, окружающих атомы. Так как силы отталкивания действуют на малых расстояниях, их эффекты становятся заметными всякий раз тогда, когда молекулы сближаются друг с другом, например при высоком давлении. Этот эффект наиболее очевиден для жидких систем, которые почти несжимаемы, однако подобные силы проявляются также в твердых системах и даже в газах при экстремальных условиях. Для разрыва различных связей требуется затратить энергию от менее 10 кДж/моль в случае слабых дисперсионных сил до 1000 кДж/моль для прочных электровалентных (ионных) структур. Так как все эти силы играют ту или иную роль в поверхностных явлениях, последние очень различаются. Один фактор, однако, является общим для всех структур: внутри объема фазы любая единица структуры подобна другой, но на поверхности это условие не выполняется. В наиболее экстремальном случае границы раздела Т/Г атом на поверхности твердого тела подвержен сильному взаимодействию с атомами собственного слоя и внутренних слоев твердого тела. Однако выше поверхности существуют только атомы газа, которые могут в результате случайных столкновений оказаться на поверхности. Такая же асимметрия существует на границе раздела Ж/Г (рис. 1). На границах раздела Ж/Ж, Т/Т и Т/Ж эта асимметрия выражена не так резко, однако переход между двумя различными фазами тем не менее всегда скачкообразен, что может влиять на заполнение поверхностных слоев в соседних фазах. Это вполне понятно в случае жидкостей, однако такой эффект нередко встречается и в твердых фазовых системах.
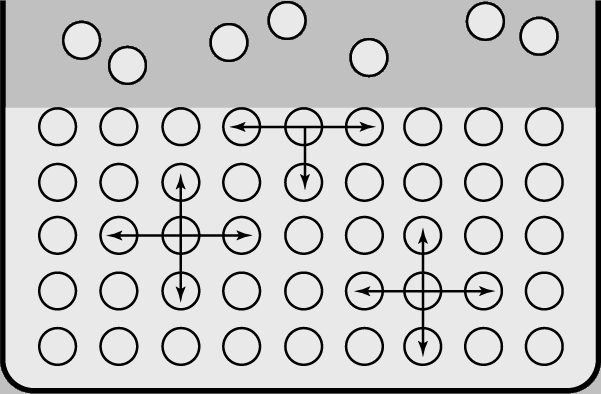 Рис. 1. АСИММЕТРИЯ ПОВЕРХНОСТНЫХ СИЛ. Атомы в жидкости одинаково взаимодействуют с другими атомами жидкости. Взаимодействия поверхностных атомов с относительно малым количеством атомов газа, которые находятся над поверхностью, относительно малы и менее часты.
Рис. 1. АСИММЕТРИЯ ПОВЕРХНОСТНЫХ СИЛ. Атомы в жидкости одинаково взаимодействуют с другими атомами жидкости. Взаимодействия поверхностных атомов с относительно малым количеством атомов газа, которые находятся над поверхностью, относительно малы и менее часты.
Граница раздела жидкость/газ. Жидкое состояние возникает вследствие существования короткодействующих сил притяжения, которые, в большинстве случаев, препятствуют выходу молекул жидкости в газовую фазу, но не мешают их движению за счет соударения друг с другом. Такое соударение является причиной хорошо известного броуновского движения
(см. также БРОУНОВСКОЕ ДВИЖЕНИЕ).
Почти полное отсутствие молекул жидкости над жидкой поверхностью является результатом действия сил притяжения соседними молекулами, вследствие чего молекулы с поверхности втягиваются вглубь объема. Поэтому капля жидкости испытывает поверхностное сжатие, как будто она покрыта эластичной оболочкой, как у воздушного шара, хотя на самом деле такой оболочки у нее нет. В терминах энергетических представлений можно сказать, что молекулы на поверхности, обладая большей энергией, чем молекулы в объеме, стремятся уменьшить свою энергию, чтобы сохранить устойчивость системы. Оба объяснения согласуются со сферической формой падающих жидких капель малого размера (сфера имеет наименьшую поверхность для данного объема) и другими следствиями существования поверхностного натяжения. Поверхностное натяжение (g) определяется как сила, отнесенная к единице длины, или как работа, затрачиваемая на создание единицы площади поверхности раздела фаз при постоянной температуре, и выражает тенденцию поверхностей к стягиванию. Исходя из стремления жидкой сферической капли к сжатию (уменьшению объема), равновесное состояние может быть достигнуто только при наличии избыточного давления DP внутри капли:

где r — радиус капли. Для капли с двумя радиусами кривизны

причем при r1 = r2 уравнение (2) превращается в (1). Интересное приложение, вытекающее из уравнения (2), получается в случае общей пленки мыла на сближенных концах двух открытых трубок (рис. 2). Давления внутри и снаружи пленки равны и, согласно (2), это возможно, только если r1 = -r2.
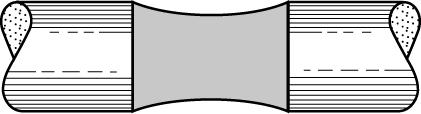 Рис. 2. ПЛЕНКА МЫЛА между двумя открытыми трубками
Рис. 2. ПЛЕНКА МЫЛА между двумя открытыми трубками
Силы, отличные по природе от поверхностного натяжения, изменяют сферическую форму капли. Так, гравитационные и аэродинамические силы, а также взаимодействия (как в случае падающих капель дождя) с другими жидкими и твердыми телами влияют на форму капли. Один из простейших методов измерения g основан на использовании таких взаимодействий на границе раздела Ж/Т. Если жидкость смачивает внутреннюю поверхность трубки (рис. 3,а), жидкость поднимается и граница раздела Г/Ж принимает вогнутую полусферическую форму. Из уравнения (1) следует, что давление внутри столба жидкости будет меньше давления воздуха на величину 2g/r; это и объясняет поднятие столба жидкости в трубке. В нейтральном состоянии, q=0,

где h — высота столба, r — разность плотностей жидкости и пара и g — ускорение силы тяжести. Когда жидкость не смачивает трубку, ее уровень в трубке понижается относительно уровня поверхности жидкости в резервуаре и возникает выпуклый полусферический мениск (рис. 3,б). В этом случае давление внутри мениска превышает давление воздуха на величину:

Это объясняет понижение уровня жидкости в трубке на рис. 3,б. В таких случаях контактный угол (q) не может быть нулевым, и потому требуется введение cosq.
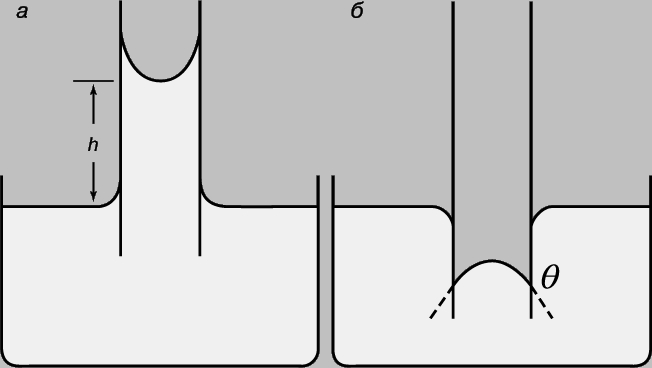 Рис. 3. КАПИЛЛЯРНЫЕ ЭФФЕКТЫ, которые могут быть использованы для измерения поверхностного натяжения. а — подъем смачивающей жидкости (например, воды) в трубке; б — понижение уровня несмачивающей жидкости (например, ртути).
Рис. 3. КАПИЛЛЯРНЫЕ ЭФФЕКТЫ, которые могут быть использованы для измерения поверхностного натяжения. а — подъем смачивающей жидкости (например, воды) в трубке; б — понижение уровня несмачивающей жидкости (например, ртути).
Другие статические методы измерения g включают измерение силы, необходимой для отрыва металлического кольца или стеклянной пластинки от жидкой поверхности, либо измерение веса или объема капли, которая полностью отделяется (капает) из вертикальной трубки точно определенной формы. Динамический метод определения g позволяет измерять поверхностное натяжение в различное время после образования поверхности, используя явление осцилляции струи. Если струя жидкости вытекает из трубки эллиптического сечения, поверхностное натяжение вызывает пульсацию поперечного сечения струи, при этом возникающие осцилляции можно сфотографировать. Из других параметров, которые можно определить данным методом, отметим расчет изменения g как функции времени, имеющий большое значение для понимания природы поверхностных процессов (см. ниже). Распад истекающей из трубки струи жидкости — одно из хорошо известных проявлений поверхностного натяжения; волны, падающие на берег моря, — другое.
Адсорбция и поверхностные пленки. До сих пор рассматривались чистые жидкости. Однако двухкомпонентные жидкости обладают другими чрезвычайно важными поверхностно-химическими свойствами. Многие растворенные вещества оказывают очень слабое влияние на g, которое отражает изменение состава поверхностного слоя. Некоторые вещества вызывают заметное понижение поверхностного натяжения воды. Такие вещества известны как дифильные, т.е. обладающие смешанными функциями. Это означает, что растворенная молекула обладает как полярной (гидрофильной, т.е. имеющей сродство к воде), так и неполярной (гидрофобной, т.е. не имеющей такого сродства) частями. Типичными представителями соединений такого типа, известных как поверхностно-активные вещества (ПАВ), являются жирные кислоты с короткой или средней длиной углеводородной цепи, однако в природе известны (например, холат натрия и лецитин) или были синтезированы (многие синтетические детергенты) многочисленные варианты соединений со смешанными функциями. Кроме того, существуют многочисленные биополимеры, обладающие поверхностной активностью. Для таких веществ состояние минимальной энергии достигается путем ориентации молекул на поверхности или вблизи нее таким образом, что гидрофобные группы стремятся расположиться вне водной фазы, а полярные, ионогенные группы обращены в сторону водной фазы (рис. 4,а). Во многих случаях концентрация ПАВ на поверхности значительно больше, чем в объеме жидкости, что соответствует тенденции, противоположной нормальной тенденции к стягиванию, что и объясняет понижение g. При этом макромолекулярные ПАВ, обладающие малой подвижностью, могут медленно (постепенно) изменять g тем больше, чем больше молекул приближается к поверхности, вследствие чего наступает молекулярная перестройка поверхностного слоя. В подобных случаях вместо статических методов измерения g применяются динамические методы. В данном случае речь идет об избытке вещества на единицу поверхности (Г), на которой оно адсорбируется. В фундаментальном термодинамическом подходе Дж.Гиббс вывел выражение для изотермы адсорбции, которое в упрощенной форме можно представить так:

где с — концентрация ПАВ, R — универсальная газовая постоянная и Т — абсолютная температура. Таким образом, если при увеличении концентрации g уменьшается, Г (называемая также "гиббсовской адсорбцией") является положительной величиной. Уравнение (5) применимо к системам, находящимся в равновесии, что было неоднократно подтверждено экспериментально, однако оно неприменимо к таким системам, свойства которых изменяются во времени из-за замедленной диффузии или поверхностных реакций.
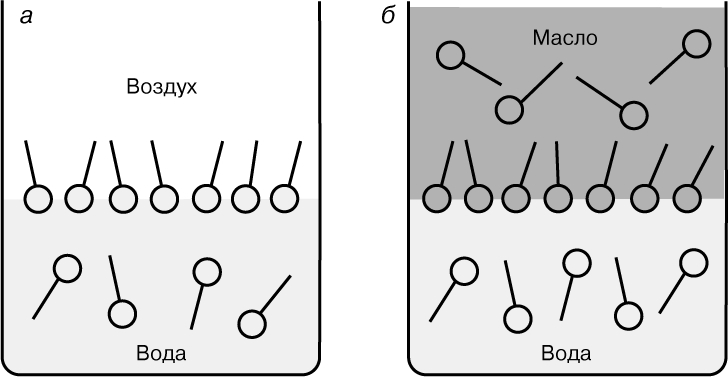 Рис. 4. АДСОРБЦИЯ ИЗ РАСТВОРА. а — граница раздела воздух/вода; б — граница раздела масло/вода.
Рис. 4. АДСОРБЦИЯ ИЗ РАСТВОРА. а — граница раздела воздух/вода; б — граница раздела масло/вода.
Уравнение (5) можно использовать (для расчета Г) только в тех случаях, когда концентрация растворенного вещества является измеряемой величиной. С увеличением гидрофобной части молекулы ПАВ (например, углеводородной цепи молекулы жирной кислоты) растворимость значительно понижается, и, наконец, вещество становится практически нерастворимым в воде. Так, жирные кислоты с углеводородной цепью длиннее, чем С14, нерастворимы в воде, но хорошо растворимы в летучих углеводородных растворителях, таких, как гексан. Например, если каплю такого раствора стеариновой кислоты C17H35COOH поместить на поверхность воды, то после быстрого испарения растворителя молекулы стеариновой кислоты заполнят поверхность водного слоя, создавая мономолекулярную пленку, при этом СООН-группы ориентированы по направлению к водной фазе. Эта пленка очень похожа на адсорбированный слой жирных кислот с короткой углеводородной цепью (рис. 4,а). В 1917 И. Ленгмюр сконструировал аппаратуру для изучения таких пленок. Измерив поверхность, покрываемую данным количеством вещества, он подтвердил предположения А.Покелс и Дж.Рэлея о том, что пленки имеют толщину монослоя. Он также показал с помощью измерения поверхностного давления как функции площади поверхности пленки, что при низком давлении пленка обладает свойствами "идеального газа", а при повышении давления наступает конденсация до состояния, которое можно рассматривать как двумерную аналогию жидкости и твердого тела. Многие научные школы (в частности У.Харкинса, Э.Райдила и Н.Адама) использовали эту технику применительно к большому числу соединений. Было изучено, например, такое физическое свойство пленок, как вязкость, и определены некоторые электрические параметры; в других случаях поверхность расширяющегося монослоя молекул дает информацию о химической природе соединения. В.Ла Мер и др. предложили использовать расширяющиеся пленки соответствующих соединений для предотвращения испарения жидкости из резервуаров. Ленгмюр и К.Блоджетт обнаружили, что растягивающиеся мономолекулярные пленки можно наносить на стекло или металл путем протаскивания пластинок через пленку. Повторением процесса можно приготовить полислойные покрытия известной толщины. Эта техника активно применяется при изготовлении элементов микроэлектроники (полупроводниковых плат).
Граница раздела жидкость/жидкость. Типичной границей раздела Ж/Ж является граница между водой (В) и маслом (М) — компонентами, не имеющими или имеющими слабое сродство друг к другу. Такая граница довольно явно выражена, хотя и не так резко, как это наблюдается для границы раздела Ж/Г (рис. 1). Возрастание общей поверхности соприкосновения путем диспергирования одной фазы (в виде малых капель) в другой происходит медленно, в то время как обратный переход к начальным фазам — быстро, причем движущей силой обратного процесса является тенденция к сокращению поверхности и уменьшению поверхностной энергии. Дифильные вещества (например, жирные кислоты), добавляемые в систему, распределяются на границе раздела Ж/Ж таким образом, что сродство различных частей молекулы к разным фазам вызывает понижение поверхностной свободной энергии и стабилизирует границу раздела. Сходство между видами распределения молекул на границах раздела Ж/Г и Ж/Ж можно видеть на рис. 4,а,б; основное различие заключается в присутствии молекул ПАВ в масляном слое. Распределение ПАВ, показанное на рис. 4,б, в равной степени относится к эмульсиям масла в воде (М/В) или воды в масле (В/М), так что оба типа эмульсий (или дисперсий) стабилизируются подходящими соответствующими ПАВ (рис. 5).
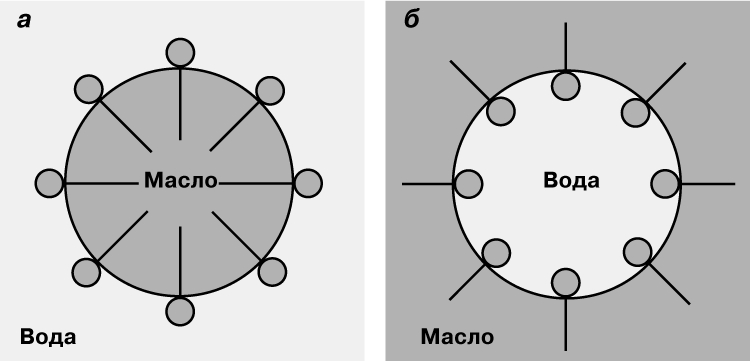 Рис. 5. ОРИЕНТАЦИЯ ПОВЕРХНОСТНЫХ МОЛЕКУЛ. а — эмульсия М/В; б — эмульсия В/М.
Рис. 5. ОРИЕНТАЦИЯ ПОВЕРХНОСТНЫХ МОЛЕКУЛ. а — эмульсия М/В; б — эмульсия В/М.
Фаза, состоящая из малых капель, известна как дисперсная фаза; непрерывная фаза называется дисперсионной средой. На практике некоторые ПАВ лучше подходят для стабилизации границы раздела М/В, чем В/М, другие — наоборот. Наконец, диспергированные твердые частицы часто обладают сильным стабилизирующим действием, адсорбируясь таким образом, что среда, которая их смачивает, становится непрерывной фазой (дисперсионной средой). Существуют и другие факторы, определяющие тип дисперсий, из которых особенно важными являются относительные объемы двух фаз. Низкое отношение объемов масла к воде приводит к образованию М/В-эмульсий, в то время как при высоких отношениях следует ожидать образования В/М-эмульсий. Эти предельные типы эмульсий сильно различаются из-за значительного различия свойств дисперсионных сред в каждом из этих случаев. Как правило, диаметр капель в эмульсиях изменяется в широких пределах, но обычно находится в области от 0,1 до 10 мкм; при таких сравнительно больших размерах частиц эмульсии (называемые макроэмульсиями) не являются высокостабильными системами. Диспергированные капли находятся в броуновском движении, и если бы не наличие сил отталкивания, действующих между ними (например, электростатических эффектов), столкновения между ними должны были бы привести к агрегации и разрушению системы, что в конечном счете и происходит. При указанных выше размерах капель и существующих различиях в плотностях масла и воды капли эмульсии имеют тенденцию к всплытию или оседанию при отстаивании; обычно агрегация происходит на поверхности. Макроэмульсии нестабильны термодинамически. Если уменьшить размер частиц, а поверхность соответствующим образом стабилизировать (скажем, при помощи сильного отталкивательного взаимодействия), то можно получить стабильные эмульсии. На практике получены эмульсии с размером капель от 0,01 до 0,1 мкм. Эти микроэмульсии могут быть как типа М/В, так и типа В/М, и часто содержат добавки спирта или других компонентов. Ключевые свойства эмульсий можно проиллюстрировать при использовании их в медицине. В некоторых случаях лекарственное средство нельзя приготовить в водорастворимой форме, но можно использовать в форме эмульсии, если растворить его в масле и диспергировать в воде. Эмульсии имеют большое значение в технологии производства пищевых продуктов (особенно молочных), фармацевтических препаратов, косметических средств, красок, сельскохозяйственной продукции, в нефтяной и нефтеперерабатывающей промышленности и многих других областях производства.
Дисперсии Г/Ж, Ж/Г и Г/Т — пены и аэрозоли. Эти системы логично было бы рассмотреть выше в разд. "Граница раздела жидкость/газ". Однако они имеют много общего с системами Ж/Ж. Газ можно диспергировать в жидкости для создания пены, но так же, как и в случае эмульсий, при использовании чистой жидкости получается только нестабильная пена. Для достижения стабильного состояния необходимые специальные пенообразующие агенты — пенообразователи, которые по своей природе подобны эмульгаторам. Для водных систем их стабилизирующий эффект достигается за счет локализации полярных или ионогенных групп в жидкой пленке между пузырьками газа по направлению к водной фазе, а гидрофобных групп — к газовой фазе. В результате этого поверхностное натяжение и свободная энергия уменьшаются. В разбавленных пенах пузырьки газа обычно имеют сферическую форму и не взаимодействуют друг с другом, однако, если жидкость вытекает из резервуара, пузырьки могут соприкасаться, вследствие чего развивается пузырчатая структура. Факторами, определяющими стабильность пен, является уменьшение испарения влаги из пленки и способность пленок противостоять механическим воздействиям — для выполнения второго условия требуется плотный (скорее, даже подвижный) тип структуры, что часто достигается стабилизацией твердыми порошками или полимерными добавками. Важными практическими приложениями пен является использование их в пожаротушении и в процессе флотации для разделения минералов. См. также
ПОЖАРНАЯ ПРОФИЛАКТИКА И ПРОТИВОПОЖАРНАЯ ЗАЩИТА. Такой же важной проблемой, как пенообразование и стабильность пен, является проблема их разрушения, когда пенообразование нежелательно, например на реках и при по очистке сточных вод. Достигнуть этого можно путем разбрызгивания различных органических соединений или ПАВ противоположного пенообразованию типа действия, например, некоторых кремнийорганических соединений (пеногасителей). В том случае, когда газовые пузырьки разделены твердой фазой, получаются твердые пены. Такие пены могут быть очень стабильными, так как в них отсутствует эффект стекания жидкости. Микропористая резина является хорошо известным примером твердых пен. Другим примером служит пенополистирол — материал, в котором твердая фаза составляет лишь малую часть общего объема. Некоторые особым образом приготовленные пищевые продукты (хрустящий картофель, поп-корн, корнфлекс) также имеют структуру твердых пен. Типичными примерами дисперсий Ж/Г и Т/Г, называемых аэрозолями, являются туманы (дымка) и дымы соответственно. Смог, характерный для мест расположения предприятий тяжелой индустрии, а также крупных городов, является смесью обоих типов дисперсий. Так как размеры частиц в аэрозолях обычно малы, процесс их оседания под действием силы тяжести является медленным, а роль броуновского движения велика, и в отсутствие стабилизирующих факторов процессы столкновения между частицами могут приводить к разрушению дисперсий. Промышленные загрязнения (например, продукты неполного сгорания углеводородов, сажа, пары кислот) служат стабилизаторами этих дисперсий, что подтверждается улучшением экологической обстановки там, где проводят очистку от них выхлопных газов автомобилей и промышленных дымов. Аэрозоли применяются в качестве дезинфицирующих и инсектицидных спреев. Важными факторами, определяющими стабильность аэрозолей, являются низкое поверхностное натяжение и наличие зарядов на частицах для уменьшения вероятности столкновения между ними. Электростатические эффекты весьма результативны и для разрушения аэрозолей. Граница раздела твердое тело/газ. Граница раздела Т/Г представляет исключительную важность вследствие своей универсальности, но, кроме того, и из-за той роли, которую она играет в фундаментальных исследованиях и технологии — особенно в микроэлектронике и промышленном катализе. Во многом успех в этой области обеспечивается быстрым прогрессом в вакуумной технологии.
См. также ВАКУУМНАЯ ТЕХНИКА.
Давление до 10-9 мм рт. ст. является рутинным, однако если это необходимо, можно достигнуть величины 10-11 мм рт. ст. и даже ниже. Часто интерес представляют отдельные кристаллографические грани, получаемые методом скола или эпитаксиального выращивания, однако для получения равномерной (атомно-гладкой поверхности) необходимы электрический прогрев и бомбардировка газовыми ионами. Методы, развитые для контроля чистоты поверхности, и их модификации (дифракционные методы, фотоэлектронная и оже-спектроскопия, сканирующая электронная микроскопия и другие) также применимы для получения информации о структуре и свойствах поверхностного слоя атомов. Отражательная и абсорбционная ИК-спектроскопия позволяет изучать структуру промежуточных частиц на поверхности. Некоторые поверхностные кристаллические структуры имеют сходство с вырезанным из объема элементом, причем адсорбция на таких участках может происходить без изменения симметрии. Однако появляется все больше и больше примеров, когда чистая поверхность отличается от аналогичной структуры в объеме, причем это различие распространяется на два или три слоя атомов. Процесс адсорбции может вызвать значительную реконструкцию структуры поверхности или даже возвращение ее к объемной структуре. Такие процессы включают в себя поверхностную диффузию с возникновением террас или ступеней роста. В прошлом исследования поверхности, за некоторыми исключениями, были относительно плохо воспроизводимы вследствие наличия поверхностных загрязнений, выхода на поверхность многочисленных граней с неустановленной ориентацией, частичной аморфностью образца и его пористостью. В силу этих причин о свойствах поверхности можно было иметь только общие представления. Адсорбция газов проявляется в двух "экстремальных" формах — физической и химической, характеризующихся слабыми (часто вандерваальсовыми) и сильными валентными связями соответственно. В физической адсорбции (сорбции) определяющие ее силы по своей величине подобны силам, вызывающим конденсацию газа или пара в жидкость при низких температурах. Испарение таких адсорбированных веществ происходит легко и во многих случаях адсорбционное состояние достигается, если конечное давление приближается к своей величине от высоких или от низких значений. Другими словами, обратимость адсорбции указывает на наличие истинного равновесия. Ленгмюр, предполагая мономолекулярную толщину пленки и условие полного равновесия, когда скорость адсорбции kадс.(1 — Q)p равна скорости десорбции kдес.Q, получил в 1916 уравнение изотермы адсорбции

где Q — доля занятых адсорбционных мест, р — давление газа и K — постоянная, которая выражает отношение (kадс./kдес.) констант скорости адсорбции и десорбции при определенной температуре. При малых значениях р величина Q пропорциональна р, а при больших значениях р величина Q не зависит от р (что соответствует насыщению; см. рис. 6). Уравнение (6) часто выполняется даже тогда, когда обратимое равновесие системы остается под вопросом. Другие (большей частью эмпирические) формы изотермы предполагаются для ограниченных областей давления, например выражение, выведенное Г.Фрейндлихом:
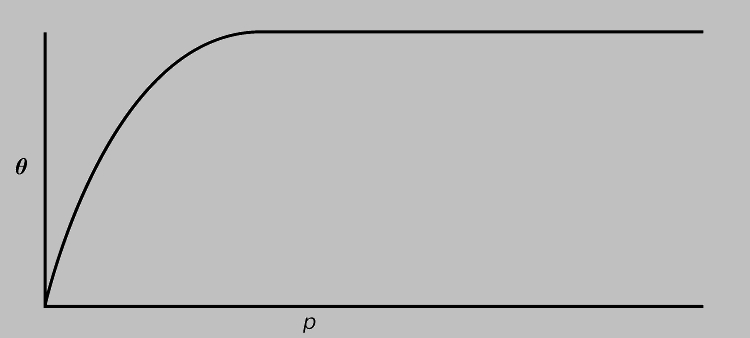 Рис. 6. ИЗОТЕРМА АДСОРБЦИИ ЛЕНГМЮРА, зависимость количества (пропорционального Q) вещества, адсорбированного на поверхности, от давления р.
Рис. 6. ИЗОТЕРМА АДСОРБЦИИ ЛЕНГМЮРА, зависимость количества (пропорционального Q) вещества, адсорбированного на поверхности, от давления р.

где n — константа для данной системы и температуры. Эти изотермы обычно плохо обоснованы теоретически. В то же время, многие адсорбенты не обладают поверхностью с равноценными адсорбционными местами. Такими адсорбентами могут быть поликристаллические образцы с многочисленными изломами или сильно пористые тела с развитой цепью капилляров, вследствие чего не наблюдается обратимая адсорбция и проявляются отчетливые гистерезисные эффекты. Другой возможной причиной необратимости является полислойная (полимолекулярная) адсорбция, особенно при давлениях, приближающихся к давлению насыщенного пара. Подобная ситуация описывается изотермой БЭТ, введенной С.Брунауэром, П.Эмметом и Э. Теллером в 1938:
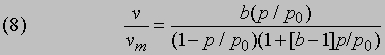
где v — объем газа, адсорбированного при давлении р, vm — полный объем монослоя адсорбированного газа, р0 — давление насыщенного пара и b — константа при постоянной температуре. Частным случаем уравнения (8) является возрастание v/vm (>1) при р -> р0; при низких значениях р, согласно уравнению изотермы Ленгмюра, v/vm пропорционально р. Уравнение (8) часто используют для определения площади поверхности практически важных адсорбентов и катализаторов. Поверхность адсорбции обычно определяется, исходя из уравнения (8) и значения vm, определяемого из экспериментальных данных по поглощению азота или какого-либо другого инертного газа в предположении, что на одну адсорбированную молекулу приходится определенная площадь поверхности. В общем случае значения площади поверхности адсорбента, определенные по уравнению БЭТ-изотермы, меняются в зависимости от выбора газа. В противоположность физической адсорбции хемосорбция определяется более сильными связями с поверхностью и приводит к образованию поверхностных соединений, которые активно взаимодействуют с субстратом. Первоначально адсорбированная молекула газа может даже распадаться на части, из которых образуются новые поверхностные частицы, что, несомненно, является основой многих процессов гетерогенного катализа. Природу такого типа соединений можно уяснить с помощью ИК-спектроскопии. Скорости образования хемосорбционных пленок сильно различаются, и можно себе представить, что в подобных случаях первой стадией процесса является физическая адсорбция, далее следует разрыв связи в молекуле и образование новых связей. Электронографические данные свидетельствуют о том, что при малых заполнениях поверхности адсорбированные молекулы располагаются на поверхности хаотично (беспорядочно), однако при дальнейшем заполнении порядок восстанавливается и теплота, выделяемая на одну адсорбированную молекулу, может уменьшаться благодаря наличию некоторого отталкивательного взаимодействия адсорбат — адсорбат. После такого энергетически выгодного образования нового слоя нельзя ожидать ни обратимости, ни полимолекулярной адсорбции. Несмотря на это изотерма Ленгмюра применима ко многим системам. Из сказанного становится ясно, как важна очистка поверхности перед началом измерений поглощения газа. Без тщательной очистки изучаемая поверхность является не чистым субстратом, а, скорее, его хемосорбированной модификацией.
Граница раздела твердое тело/жидкость. В заключение рассмотрим твердые тела, которые часто используются для селективной адсорбции из растворов, а для объяснения полученных результатов используем обе изотермы адсорбции — Ленгмюра и Фрейндлиха. Обычно имеет место мономолекулярная адсорбция, однако при концентрациях, близких к насыщению, может наступать и полимолекулярная адсорбция. Хорошо известным промышленным приложением такой адсорбции является применение древесного угля для поглощения окрашенных загрязнений из сахарных сиропов. Граница раздела Т/Ж, которая существует в коллоидных суспензиях, обеспечивает стабильность подобных, обычно гидрофобных, систем за счет наличия электростатического отталкивательного взаимодействия между частицами (рис. 7). Отрицательные заряды возникают либо вследствие ионизации поверхностных функциональных групп, либо за счет адсорбции ионов из жидкой фазы. Непосредственно вокруг частицы расположен слой молекул воды вместе с незначительным количеством противоионов. За этим сольватным заряженным слоем со стороны раствора располагается избыток противоионов; общая концентрация электролита определяет расстояние, на котором он находится. Как было показано Э.Фервеем и Я.Овербеком, это распределение заряда, называемое двойным электрическим слоем, приводит к возникновению отталкивания между частицами и вследствие этого к стабилизации системы. Однако добавление в систему ионов, особенно поливалентных, в концентрациях выше некоторого определенного предельного значения приводит к такому "сморщиванию" двойного слоя, что возникает нестабильность системы. С другой стороны, добавка поверхностно-активных веществ (например, многих белков и синтетических ПАВ) может посредством адсорбции на поверхности частицы изменить характер суспензии, превращая ее из гидрофобной в гидрофильную.
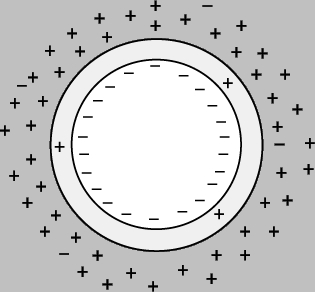 Рис. 7. ДВОЙНОЙ ЭЛЕКТРИЧЕСКИЙ СЛОЙ, две зарядные оболочки, связанные с заряженной коллоидной частицей.
Рис. 7. ДВОЙНОЙ ЭЛЕКТРИЧЕСКИЙ СЛОЙ, две зарядные оболочки, связанные с заряженной коллоидной частицей.
Двойные электрические слои возникают обычно на границе раздела между твердым телом (или ртутью) и водным раствором электролита. Наличие электрического заряда на поверхности ртути значительно понижает поверхностное натяжение, и им можно управлять путем наложения на ртутную поверхность электрического потенциала; этот эффект известен под названием электрокапиллярность. Подобно этому в случае металлического электрода в химическом источнике протекание тока происходит вследствие переноса электронов (во внешней цепи) и ионов (в растворе), и двойной электрический слой, окружающий электрод, формируется с зарядом, появляющемся на нем. В таких случаях (сюда относится и выделение водорода и кислорода) медленный перенос электронов к электроду или от него создает такой тип энергетического барьера, который можно преодолеть только приложением избыточного напряжения (перенапряжения; см. также ЭЛЕКТРОХИМИЯ).
Гетерогенный катализ. Гетерогенный катализ является основой многих химических и нефтехимических производств, а также технологий по уменьшению загрязнений в окружающей среде. Так, природные углеводороды нефти при катализе подвергаются процессу разрыва на малые органические молекулы (крекингу), а растительные масла — гидрогенизации для получения маргаринов. Различные процессы происходят за счет окисления (например, производство азотной кислоты); на этом принципе основано и действие катализаторов для удаления СО и других оксидов, а также продуктов неполного сгорания углеводородов в двигателях. Для этих и других реакций разработано много типов катализаторов, таких, как металлические, оксидные и кислотные. Многие промышленные катализаторы (например, металлические) представляют собой обычно сложную многокомпонентную смесь эмпирического состава. Металл (железо или, допустим, платина) обычно имеет вид частиц малого размера, обладающих большой общей поверхностью. Эти частицы наносятся на подложку из подходящего материала (такого, как оксид кремния или алюминия) с малой добавкой промотора (часто щелочных металлов), что обеспечивает катализатору высокую активность, селективность и стабильность. Подробности механизма действия катализатора часто неизвестны. Исследование его активности проводятся с помощью упрощенных модельных экспериментов (последовательный переход от грани монокристалла к различным поверхностным дефектам и, наконец, к соответствующим добавкам). В случае физической адсорбции с ее относительно малыми энергиями взаимодействия и, следовательно, малым нарушением молекулярной структуры адсорбата эффективность катализатора, по-видимому, в основном зависит от совместного переноса реагентов на поверхность, на которой могут происходить слабые преобразования молекулярной структуры. Подобный механизм, вероятно, лежит в основе биологических реакций, когда фермент и субстрат в адсорбированном состоянии находятся в непосредственной близости друг к другу (комплементарность). Примером таких эффектов является возрастание скорости автолиза (вид переваривания) трипсина на поверхности стекла по сравнению со скоростью этой реакции в объеме раствора; по-видимому, многие реакции и в живой клетке протекают подобным образом. В случае хемосорбции, отличающейся сильными взаимодействиями газа с твердой поверхностью, ситуация иная. Адсорбция монооксида углерода на таких металлах, как никель и медь, происходит с образованием связи металл — углерод, тогда как на железе, кобальте и некоторых других металлах адсорбированный СО распадается с образованием адсорбированных кислорода и углерода. При наличии водорода образуется либо метанол в результате поверхностной реакции (CO + 2H2 -> CH3OH), либо углеводород (nCO + 2nH2 -> CnH2n + nH2O, где n — какое-либо целое число). Как следует из результатов масс-спектрометрии, важную роль в образовании соответствующих продуктов играют интермедиаты (промежуточные соединения) этих реакций. Различные кристаллографические грани обладают различной реакционной способностью; те из них, у которых поверхностные атомы слабее взаимодействуют с субстратом, являются наиболее каталитически активными. Последующие исследования показали, что ступени роста и дефекты решетки, выходящие на поверхность, обладают повышенной каталитической активностью относительно атомно-гладкой поверхности металла. Механизм промотирующего действия катализаторов (а также механизм действия катализаторных ядов) в случае реакции CO/H2 и других был детально исследован, и была развита теория этих процессов. Исследованы также другие практически важные реакции (например, N2 + 3H2 -> 2NH3). Все еще существуют трудности в понимании механизма действия катализаторов, разработанных эмпирическим путем, однако уже возможны разработка и изготовление желаемых типов катализаторов. Современная техника, особенно сканирующая электронная микроскопия, открывает возможность наблюдения катализатора нового типа на атомном уровне в режиме реального времени.
Смачивание и смазывание. Рисунок 3,б демонстрирует, как несмачивающая жидкость в вертикальной трубке располагается ниже ее постоянного уровня. Это обусловлено отсутствием сродства между жидкостью и твердым телом. Аналогичным образом капля жидкости, помещенная на поверхность, принимает форму, показанную на рис. 8; при этом контактный угол q является характеристикой системы. В состоянии равновесия существует следующая зависимость между поверхностным и пограничным (межфазным) натяжениями:
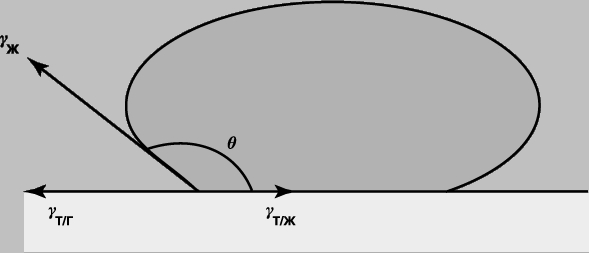 Рис. 8. ФОРМА КАПЛИ НЕСМАЧИВАЮЩЕЙ ЖИДКОСТИ на твердой поверхности (например, капли воды на куске парафина).
Рис. 8. ФОРМА КАПЛИ НЕСМАЧИВАЮЩЕЙ ЖИДКОСТИ на твердой поверхности (например, капли воды на куске парафина).
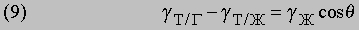
При полном смачивании q = 0, так что из уравнения (9) следует:

Уравнение (10) применимо в случае идеального равновесия; для сплошного растекания gТ/Г должно быть больше, чем gТ/Ж + gЖ; это часто происходит на практике при добавлении ПАВ в жидкость. В то же время, стекло можно сделать "водоотталкивающим" путем силиконирования, которое делает поверхность парафиноподобной (гидрофобной). Смазывание представляет собой распределение подходящей жидкости по металлическим и другим твердым поверхностям, так, что предотвращается непосредственное соприкосновение их друг с другом. Некоторые смазки содержат молекулы ПАВ с длинной углеводородной цепью, которые не только понижают поверхностное натяжение, но также эффективно превращают твердую поверхность в гидрофобную, для которой эффекты, связанные с трением, становятся малы.
См. также
ЛИТЕРАТУРА
Адамсон А. Физическая химия поверхностей. М., 1979 Дерягин Б.В., Чураев Н.В., Муллер В.М. Поверхностные силы. М., 1985 Измайлова В.Н., Ямпольская Г.П., Сумм В.Д. Поверхностные явления в белковых системах. М., 1988
