ХЛОР
Cl (chlorum),
химический элемент VII группы периодической системы элементов, член семейства галогенов (F, Cl, Br, I, At). Газообразный хлор выделил К.Шееле в 1774 по реакции соляной (хлороводородной) кислоты с пиролюзитом (MnO2), но не установил, что этот газ — именно элемент хлор. В 1785 К.Бертолле считал хлор кислородным соединением муриевого радикала, т.е., в современных терминах, оксосоляной кислотой. В 1808 Ж.Гей-Люссак, проведя синтез хлороводородной кислоты из 1 объема хлора и 1 объема водорода, сделал вывод, что хлор не содержит кислорода, и тем самым открыл поле для исследований Х.Дэви, который установил элементную природу хлора.
Распространенность в природе. В свободном виде хлор в природе не встречается, но существует множество природных хлорсодержащих соединений. Основным источником хлора является морская вода, содержащая хлорид натрия. Наиболее важные минералы хлора — это галит (или каменная соль) NaCl и хлораргирит AgCl.
Применение. Под давлением хлор превращается в жидкость, которую широко используют как отбеливатель, в частности в текстильной и бумажной промышленности, начиная с 1795. Хлор — слишком сильный окислитель для отбеливания шелка и шерсти, но эффективен для отбеливания хлопка, льна и древесной массы. Другое важное применение жидкого хлора — для очистки воды — впервые предпринято в 1895 для целей городского водоснабжения Нью-Йорка. Соединения хлора находят разнообразное применение. Хлороформ CHCl3 и хлорэтил C2H5Cl являются анестетиками, трихлорэтаналь (или хлораль) CCl3CHO применяют в медицине как наркотик, тетрахлорид углерода CCl4 используется для тушения огня, для сухой чистки, как и трихлорэтилен С2HCl3. Три хлорпроизводных — фосген COCl2 (удушающий газ), иприт (C2H4Cl)2S — кожнонарывная жидкость, хлорпикрин CCl3NO2 (слезоточивый газ) — являются боевыми отравляющими веществами. Фреон CF2Cl2 используется как хладагент в холодильной технике. Хлор применяют в производстве красок, резин, синтетического каучука, углеводородов, взрывчатых веществ и в химических синтезах. Хлор используют также для отбеливания губок и соломы.
Получение. Лабораторный метод получения хлора заключается в медленном прикапывании концентрированной соляной кислоты HCl через капельную воронку к KMnO4 или MnO2:
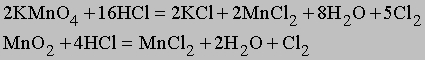
Жидкий хлор был получен М. Фарадеем в 1823 при нагревании гидрата хлора Cl2*8H2O, помещенного в один конец трубки. В результате конденсации в другом конце трубки, охлаждаемом смесью соли со льдом, собирался жидкий хлор. В промышленности хлор получают электролизом рассолов или расплавов NaCl в электролизерах с отделенным асбестовой диафрагмой анодным пространством, при этом хлор выделяется на аноде, а водород — на катоде.
Свойства. Хлор в нормальных условиях представляет собой желтовато-зеленый газ с неприятным запахом, раздражающе действующий на слизистые носа и горла. СВОЙСТВА ХЛОРА
Атомный номер 17 Атомная масса 35,453 Изотопы
стабильные 35, 37
нестабильные 33, 34, 36, 38, 39
Температура плавления, ° С -100,98 Температура кипения, ° С -34,6 Температура критическая, ° С 144 Давление критическое, атм 76,1 Содержание в земной коре, % (масс.) 0,314 Степени окисления -1, +1, +3, +4, +5, +7 Хлор непосредственно реагирует со всеми химическими элементами, кроме C, N, O и благородных газов, образуя хлориды. В смеси хлора с водородом на свету реакция протекает очень быстро, а при интенсивном освещении и отсутствии примесей возможен взрывной механизм реакции. Эта реакция, которую независимо друг от друга изучали Дж. Драйпер и Р. Бунзен в 1848, является одной из первых изученных фотохимических реакций. В среде хлора прекрасно сгорает сурьма, а также натрий и медная фольга, нагретые до красного каления. Хлор окисляет C, I, Br и S в их соединениях. При пропускании Cl2 через раствор иода выделяется свободный иод. Смоченный скипидаром хлопок вспыхивает в хлоре, образуя сажу и HCl. Хлор вступает в реакции замещения с углеводородами, например, с CH4 образует хлорметан CHCl3, дихлорметан CH2Cl2, трихлорметан (хлороформ) CHCl3 и тетрахлорметан (тетрахлорид углерода) CCl4. Хлор вступает в реакции сочетания с другими веществами, например, с CO на свету или при нагревании и образует фосген, с гашеной известью — хлорную известь CaOCl (отбеливатель), а с водой — гидрат хлора Cl2*8H2O.
Соединения хлора. Хлороводород (хлорид водорода) HCl в водном растворе был получен И.Глаубером в 1648 при взаимодействии поваренной соли и серной кислоты. Раствор HCl в воде называют хлороводородной или соляной кислотой. Эта кислота встречается в источниках рек Южной Америки, которые вытекают из вулканических районов Анд. Желудочный сок человека содержит 0,2-0,4% соляной кислоты. Хлороводород получают синтезом из Cl2 и H2 под действием света или тепла. HCl образуется также по реакции Cl2 c сероводородом или метаном и другими углеводородами. Наиболее простой способ заключается в постепенном добавлении серной кислоты к хлориду натрия (поваренной соли) при слабом нагревании: NaCl + H2SO4 = NaHSO4 + HCl. При использовании твердой соли и более сильном нагревании образуется сульфат натрия: NaCl + NaHSO4 = Na2SO4 + HCl. HCl — резко пахнущий бесцветный газ, который можно конденсировать в бесцветную жидкость, кипящую при -83,7° C и затвердевающую при -112° C. Газ в 1,26 тяжелее воздуха, очень хорошо растворим в воде (442 объема на 1 объем воды при 20° С). Концентрированная соляная кислота содержит 37% HCl (плотность 1,19 г/мл). 20,24%-ный раствор HCl имеет температуру кипения 110° С. Соляная кислота широко используется в лабораторной практике, для обработки поверхности металлов перед пайкой, для травления их, в крашении, ситценабивном деле, производстве клея, мыла, глюкозы и др. Смесь 3 объемов конц. HCl и 1 объема конц. HNO3 известна в лабораторной практике под названием царская водка; она растворяет золото и другие благородные металлы.
Оксиды. Хлор образует оксиды Cl2O, ClO2 и Cl2O7. Все оксиды хлора нестабильны, могут разлагаться со взрывом, являются сильными окислителями, вызывают возгорание органических соединений, например бумаги, дерева и сахара. Cl2O — желтовато-красный газ — образуется при пропускании Cl2 над оксидом ртути при низкой температуре. При растворении его в воде образуется хлорноватистая кислота HClO. ClO2 — темножелтый газ, в промышленности его получают действием хлора на сухой хлорит натрия NaClO2. ClO2 применяют в отбеливающих порошках, в производстве бумаги и текстиля. Cl2O7 — бесцветная маслянистая жидкость, более стабильна, чем другие оксиды, но при определенных условиях также может взрываться. Cl2O7 получают обезвоживанием HClO4 в присутствии P4O10.
Оксокислоты. Хлорноватистая кислота HClO слабая, ее соли гипохлориты являются окислителями и применяются для дезинфекции и для отбеливания. Раствор Дакина, содержащий гипохлорит натрия, применяли для обработки открытых ран во время Первой мировой войны. Хлористую кислоту HClO2 получают по реакции хлорита бария с серной кислотой. Кислота стабильна только в очень разбавленных растворах, а в безводном состоянии не получена. Хлорноватая кислота HClO3 максимальной концентрации 40 % получается при разложении гипохлорита или по реакции хлората бария с разбавленной серной кислотой, при концентрации выше 40% кислота разлагается. Сама кислота и ее соли хлораты — сильные окислители. При нагревании KClO3 (бертоллетова соль) разлагается с выделением кислорода. Поэтому соль используют для изготовления спичек, сигнальных огней и в фейерверках. Хлорную кислоту HClO4 получают осторожной перегонкой смеси ее натриевой соли (перхлората натрия) с конц. HCl при пониженном давлении, так как кислота кипит при 16° С (18 мм рт.ст.). Эта реакция взрывоопасна. Чистая хлорная кислота — летучая бесцветная жидкость, является сильнейшим окислителем, в ее концентрированных растворах возгораются бумага и дерево. Cl2O7 является ангидридом этой кислоты, а ее соли (перхлораты) — наиболее устойчивые из солей кислородных кислот хлора. Хлорная кислота находит применение в аналитической химии как окислитель, а смесь перхлората бария и перхлората магния — как осушитель. Перхлораты используют также в производстве спичек и взрывчатых веществ.
См. также
ХИМИЧЕСКОЕ И БИОЛОГИЧЕСКОЕ ОРУЖИЕ.
ЛИТЕРАТУРА
Фурман А.А. Неорганические хлориды. М., 1980 Фрумина Н.С. и др. Хлор. М., 1983
Значения в других словарях
- Хлор — (лат. Chlorum) Cl, химический элемент VII группы периодической системы Менделеева, атомный номер 17, атомная масса 35,453; относится к семейству галогенов (См. Галогены). Большая советская энциклопедия
- хлор — -а, м. Химический элемент, удушливый газ зеленовато-желтого цвета с резким запахом (используется в производстве для синтеза неорганических и органических продуктов, а также для обеззараживания воды, отбелки тканей и целлюлозы). [От греч. χλωρός — зеленый] Малый академический словарь
- хлор — орф. хлор, -а Орфографический словарь Лопатина
- хлор — Хлор/. Морфемно-орфографический словарь
- хлор — ХЛОР (от греч. chloros — желто-зеленый; лат. Chlorum) Cl хим. элемент VII гр. периодической системы, относится к галогенам; ат. н. 17, ат. м. 35,453. Прир. Химическая энциклопедия
- хлор — ХЛОР а, м. chlore m. | нем. Chlor н.-лат. chlorum <�гр. chloros зеленовато-желтый. Остро пахнущий, ядовитый, желто-зеленый газ, — отравляющее и обеззараживающее средство. Соединения хлора. БАС-1. Крысин 1998. Словарь галлицизмов русского языка
- хлор — ХЛОР (Chlorum) , Cl хим. элемент VII гр. периодич. системы Менделеева. Галоген, жёлто-зелёный газ с резким запахом. Встречается в природе только в виде соединений. Ср. содержание в земной коре 1,7-10-2% (по массе). Сельскохозяйственный словарь
- хлор — Заимств. в XIX в. из новолат. яз., где chlorum < греч. chlōros «желтовато-зеленый». Газ назван по своему цвету. Этимологический словарь Шанского
- ХЛОР — ХЛОР (символ С1), широко распространенный неметаллический элемент, один из ГАЛОГЕНОВ (элементы седьмой группы периодической таблицы), впервые открытый в 1774 г. Он входит в состав поваренной соли (NaCl). Научно-технический словарь
- Хлор — (Chlorum, Cl; от греч. chlōros зеленовато-желтый, бледно-зеленый) химический элемент подгруппы галогенов VII группы периодической системы элементов Д.И. Медицинская энциклопедия
- Хлор — Cl (лат. Chlorum; от греч. chloros — жёлто-зелёный * a. chlorine; н. Chlor; ф. chlore; и. cloro), — хим. элемент VII группы периодич. системы Mенделеева; относится к галогенам, ат. н. 17, ат. м. 35,453. Горная энциклопедия
- хлор — ХЛОР, а, м. Химический элемент, газ жёлто-зелёного цвета с резким запахом. | прил. хлористый, ая, ое и хлорный, ая, ое. Хлористый кальций. Хлористый аммоний. Хлорная известь (зернистый белый порошок, употр. в технике и санитарии). Толковый словарь Ожегова
- хлор — ХЛОР, хлора, мн. нет, ·муж. (от ·греч. chloros — зеленый) (·хим. ). Химический элемент, удушливый газ, употр. в технике, в санитарии как обеззараживающее и в военном деле как отравляющее вещество. Толковый словарь Ушакова
- хлор — ХЛОР -а; м. [от греч. chlōros — бледно-зелёный] Химический элемент (Cl), удушливый газ зеленовато-жёлтого цвета с резким запахом (используется как отравляющее и обеззараживающее средство). Соединения хлора. Отравление хлором. ◁ Хлорный (см.). Толковый словарь Кузнецова
- хлор — ХЛОР м. греч. одно из химических начал, основ, в поваренной соли. Хлоральгидрат получается при действии хлора на безводный спирт, кристаллизованное вешество; употр. как усыпляющее средство (Наумов). Хлоровый газ. Хлорные соли. Толковый словарь Даля
- хлор — Хлора, мн. нет, м. [от греч. chloros – зеленый] (хим.). Химический элемент, удушливый газ, употр. в технике, в санитарии как обеззараживающее и в военном деле как отравляющее вещество. Большой словарь иностранных слов
- ХЛОР — ХЛОР (лат. Chlorum) — Cl, химический элемент VII группы периодической системы Менделеева, атомный номер 17, атомная масса 35,453, относится к галогенам. Название от греч. chloros — желто-зеленый. Большой энциклопедический словарь
- хлор — хлор м. Химический элемент, удушливый газ зелёного цвета, употребляющийся в технике, санитарии и т.п. как отравляющее или обеззараживающее средство. Толковый словарь Ефремовой
