ТЕРМОДИНАМИКА
Раздел прикладной физики или теоретической теплотехники, в котором исследуется превращение движения в теплоту и наоборот. В термодинамике рассматриваются не только вопросы распространения теплоты, но и физические и химические изменения, связанные с поглощением теплоты веществом, а также, наоборот, выделение теплоты в ходе физических и химических превращений.
См. также
ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА. Термодинамика находит широкое применение в физической химии и химической физике при анализе физических и химических процессов, в современной физиологии и биологии, в двигателестроении, теплотехнике, авиационной и ракетно-космической технике. Первоначально в термодинамике много внимания уделялось обратимым процессам и равновесным состояниям, так что более подходящим для нее казалось название "термостатика", но благодаря С. Аррениусу (1859-1927) и Г. Эйрингу (1901-1981) получило весьма основательную разработку ее применение к анализу скоростей химических реакций (химической кинетике) -см. также ХИМИЧЕСКАЯ КИНЕТИКА И ХИМИЧЕСКОЕ РАВНОВЕСИЕ.
В настоящее время главной проблемой в термодинамике является ее применение к необратимым процессам, и уже достигнуты большие успехи в построении теории, по широте охвата сравнимой с термодинамикой обратимых процессов.
ЭНЕРГИЯ
Для той физической величины, которую мы теперь называем энергией, долгое время употреблялся термин "живая сила", введенный И. Ньютоном (1643-1727). Но поскольку "живую силу" можно было спутать с обычной силой, последнюю приходилось для ясности называть "мертвой силой", что нельзя признать удачным. Специальный термин "энергия" был введен в 1807 Т. Юнгом (1773-1829). Одним из видов энергии является работа, которая совершается, когда тело движется, преодолевая действие некой силы. Примером может служить подача насосом воды в водонапорную башню. О воде в башне говорят, что она имеет потенциальную энергию. Благодаря гравитационному притяжению Земли существует возможность обратного преобразования этой энергии в кинетическую, т.е. в энергию движения воды, текущей по трубам. Когда вода в трубе в конце концов останавливается из-за внутреннего трения, или вязкости, эта энергия оказывается превратившейся в теплоту, т.е. тепловую энергию, которая рассеивается в окружающей среде. Еще в 1620 Ф. Бэкон высказал предположение, что теплота есть просто другая форма движения, но лишь в 1789 это с несомненностью установил Б. Томпсон (Румфорд), наблюдая за выделением теплоты при рассверливании ствола пушки. Дополнительным подтверждением явились опыты Х. Дэви 1799. Эти опыты и наблюдения говорили о том, что тепловая и механическая энергия — одно и то же и что, вероятно, можно найти экспериментально механический эквивалент теплоты, т.е. количество работы в механических единицах, эквивалентное данному количеству теплоты в тепловых единицах.
Механический эквивалент теплоты. Заметив, что температура воды в медицинской колбе повышается, если ее несколько минут встряхивать, Ю.Майер в 1842 вычислил механический эквивалент теплоты по разности удельных теплоемкостей воздуха при постоянном давлении и постоянном объеме. В ту пору точные значения этих удельных теплоемкостей еще не были известны, а потому его результат был не совсем верным, хотя и правильным по порядку величины. В 1845 Дж. Джоуль точно измерил количество теплоты, получаемое при преобразовании механической работы в тепловую энергию, и уточнил результат Майера.
Работа. Если некое вещество находится под ограничивающим воздействием внешней силы, например атмосферного давления P, то при изменении его объема V, скажем расширении, вследствие движения против действующей силы совершается работа. Полную совершаемую работу можно найти как площадь зависимости силы от соответствующего размера, как показано на рис. 1, где площадью участка, выделенного ретушью, представлена работа, совершаемая газом при расширении от V1 до V2. Такой способ ее определения необходим, поскольку давление может меняться. При малом изменении объема давление намного не изменится, так что малое количество совершаемой работы будет равно: 
Следовательно, полная совершаемая работа 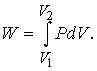
При быстром сжатии газа некоторая часть работы, совершаемой над ним, может заметно повысить его температуру. Если газ находится в теплоизолированном сосуде (или сжимается столь быстро, что не успевает хотя бы частично отдать свою теплоту), такое изменение объема называется адиабатическим. Если же газ не теплоизолирован, то происходит теплоотдача, и газ сохраняет температуру окружающей среды. Такое изменение объема называется изотермическим.
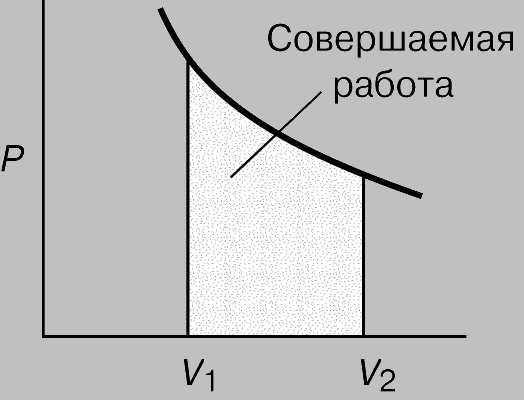 Рис. 1. РАБОТА, СОВЕРШАЕМАЯ ГАЗОМ при расширении от объема V1 до V2. Равна площади под криволинейной зависимостью объем — давление.
Рис. 1. РАБОТА, СОВЕРШАЕМАЯ ГАЗОМ при расширении от объема V1 до V2. Равна площади под криволинейной зависимостью объем — давление.
"Полезность" энергии. Полное преобразование работы в теплоту вполне возможно, но обратный процесс преобразования всей теплоты в эквивалентную ей работу невозможен. К такому выводу еще в 1824 пришел путем теоретических рассуждений французский физик Н.Карно (1796-1832). Рассматривая полный цикл обратимых изменений рабочего тела в тепловой машине, в конце которого это тело возвращается в исходное состояние, он показал, что максимальный КПД преобразования теплоты в работу зависит не от природы рабочего тела, а только от максимальной температуры, при которой подводится теплота, и от минимальной температуры, при которой она отводится. Полное преобразование теплоты в работу было бы возможно лишь в том случае, если бы минимальная температура была равна абсолютному нулю, при которой рабочее тело не имело бы никакой тепловой энергии. На существование абсолютного нуля указывает закон расширения газов. Поскольку при охлаждении от 0 до -1° C газы сжимаются на 1/273, можно представить себе некий "идеальный" газ, который не конденсируется, как реальные газы, но с понижением температуры продолжает сжиматься, пока его объем не уменьшится до нуля при -273° C. Это было бы абсолютным нулем температуры для тепловой машины, рабочим телом которой является идеальный газ. Проведя гораздо более сложные рассуждения, У. Томсон (Кельвин) (1824-1907) доказал, что это действительно абсолютный нуль температуры, и ввел названную его именем "термодинамическую" шкалу температуры T (шкалу Кельвина), в соответствии с которой T = 273,16 + t° C.
Первое начало термодинамики. Для В. Лейбница (1646-1716) было уже неоспоримым, что в консервативной системе (подобной гравитационному полю) сумма кинетической и потенциальной энергий остается неизменной, какие бы преобразования одной в другую ни происходили. Простой пример — маятник, кинетическая энергия которого периодически переходит в потенциальную и обратно, причем это могло бы продолжаться до бесконечности, если бы энергия не рассеивалась из-за трения. Однако имеется трение в подвесе, а также сопротивление воздуха, тоже обусловленное трением. Поэтому маятник в конце концов теряет кинетическую энергию своего видимого движения, но опыты Румфорда и других ученых свидетельствовали о том, что энергия лишь превращается в теплоту, и в результате этого повышается температура маятника и окружающей среды. Таким образом, строго периодические колебания маятника превращаются в хаотическое движение его молекул и молекул окружающей среды. Все изложенное находит общее выражение в первом начале термодинамики — законе сохранения энергии. Согласно этому закону, во всех таких преобразованиях энергия не возникает и не исчезает, она лишь меняет форму. На это указал в 1837 замечательный, но почти неизвестный мыслитель К.Мор в своей статье О природе теплоты (On the Nature of Heat): "При подходящих условиях энергия может проявляться как движение, слипание, электричество, свет, теплота и магнетизм". Закон сохранения энергии был четко сформулирован в 1847 Г.Гельмгольцем (1821-1894), но и после этого универсальный характер закона не сразу получил признание. В 20 в. его пришлось еще более обобщить, включив в него теоретически установленное А.Эйнштейном соотношение E = mc2 между массой m и энергией E (c — скорость света), из которого следует, что сумма массы и энергии остается неизменной.
Второе начало термодинамики. Хотя полная энергия изолированной системы остается постоянной, теплота передается от нагретой части системы к более холодной, и, если эти части не изолированы друг от друга, их температура в конце концов становится одинаковой. Данное положение, известное нам из опыта повседневной жизни, иногда называют "нулевым" началом термодинамики. В результате такого выравнивания внутренних температур изолированная система переходит в свое наиболее вероятное состояние, в котором движение предельно хаотично. Такое самопроизвольное стремление к состоянию с наивысшей степенью хаотичности есть, иначе говоря, стремление к максимальной энтропии, которую можно рассматривать как меру "бесполезности" энергии в термодинамической системе. Суть второго начала термодинамики, сформулированного в 1850 Р. Клаузиусом (1822-1888), и состоит в том, что в изолированной системе внутреннее распределение энергии самопроизвольно всегда изменяется так, что энтропия достигает максимального значения ценой уменьшения полезной части энергии. В силу этого невозможен вечный двигатель второго рода (перпетуум-мобиле II). Необратимое нарастание энтропии в тепловых процессах непонятно тем, кто только начал знакомиться с термодинамикой, но его нетрудно объяснить, опираясь на теорию вероятностей. Представим себе две игральные кости, лежащие вверх шестерками. Если мы потрясем их, прежде чем снова выбросить, то вероятность выпадения двух шестерок будет мала — 1:36. Таким образом, можно сказать, что беспорядочное движение (перемешивание) игральных костей, подобно хаотическому движению молекул, соответствующему их тепловой энергии, оказывается причиной перехода из менее вероятного состояния в более вероятное. Если же у нас миллионы игральных костей (атомов и молекул, для которых проводятся термодинамические расчеты), то вероятность одновременного выпадения всех шестерок столь ничтожно мала, что система просто не может не перейти в одно из более вероятных состояний. Если теплота — беспорядочное колебательное движение молекул, то при охлаждении энтропия системы должна уменьшаться. Когда же тепловое движение полностью прекратится, система будет при абсолютном нуле температуры. Естественно предположить, что при такой температуре энтропия равна нулю.
Третье начало термодинамики. Чтобы найти абсолютное значение энтропии, необходимо знать теплоемкость при абсолютном нуле температуры. Измерив теплоемкость многих веществ при температурах, очень близких к абсолютному нулю, В.Нернст (1864-1941) пришел к выводу, что теплоемкость всех кристаллических веществ при абсолютном нуле температуры равна нулю. Эта "тепловая теорема Нернста" теперь называется третьим началом термодинамики. Ее значение в том, что она позволяет сравнивать между собой энтропии разных веществ, так как все они равны нулю при абсолютном нуле температуры.
ТЕПЛОВЫЕ МАШИНЫ
Цикл Карно. К 1824, когда Карно опубликовал свой трактат Размышления о движущей силе огня... (Rflections sur la puissance motrice du feu...), было уже хорошо известно, что за счет теплоты можно получать механическую энергию, но ни у кого не было ни малейшего представления о том, каким может быть КПД тепловой машины, и были не совсем ясны термодинамические основы ее действия. Прошло десять лет, прежде чем Б.Клапейрон, который первым по достоинству оценил трактат Карно, повторно опубликовал его, снабдив важными дополнениями. Карно представлял тепловую машину (рис. 2) в виде идеально теплоизолированного цилиндра, наполненного фиксированным количеством рабочего тела (газа) и снабженного движущимся без трения поршнем. Машину можно без энергетических потерь переносить с одной подставки на другую. Одна подставка, поддерживаемая при температуре T1, служит нагревателем. Другую, поддерживаемую при более низкой температуре T2, назовем холодильником. Сначала цилиндр стоит на нагревателе, и газообразное рабочее тело изотермически (т.е. поглощая теплоту так, что его температура не изменяется) расширяется от точки 1 до точки 2 на графике зависимости объем — давление (рис. 3,а). Затем машину переносят на теплоизолированную подставку и газ адиабатически расширяется от точки 2 до точки 3, совершая работу — поднимая поршень. В результате он охлаждается до температуры T2. После этого машину переставляют на холодильник, и газ изотермически сжимается от точки 3 до точки 4, отдавая теплоту холодильнику. Переставив затем машину снова на теплоизолированную подставку, можно теперь адиабатически сжать газ от точки 4 до точки 1 и вернуть его в исходное состояние (к прежним значениям температуры, объема и давления), так что цикл может начаться снова.
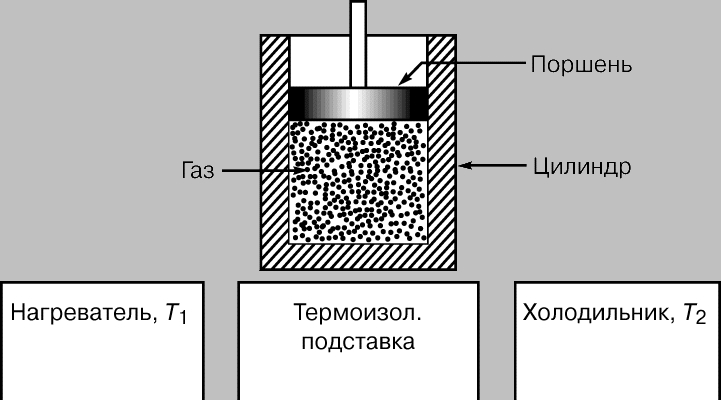 Рис. 2. ЦИКЛ КАРНО для воображаемой машины, идеально теплоизолированной, с фиксированным количеством рабочего газа и с поршнем, движущимся в рабочем цилиндре без трения. Цикл состоит в переносе машины с нагревателя на теплоизолированную подставку, затем на холодильник и снова на теплоизолированную подставку. При расширении и сжатии газа поршень перемещается.
Рис. 2. ЦИКЛ КАРНО для воображаемой машины, идеально теплоизолированной, с фиксированным количеством рабочего газа и с поршнем, движущимся в рабочем цилиндре без трения. Цикл состоит в переносе машины с нагревателя на теплоизолированную подставку, затем на холодильник и снова на теплоизолированную подставку. При расширении и сжатии газа поршень перемещается.
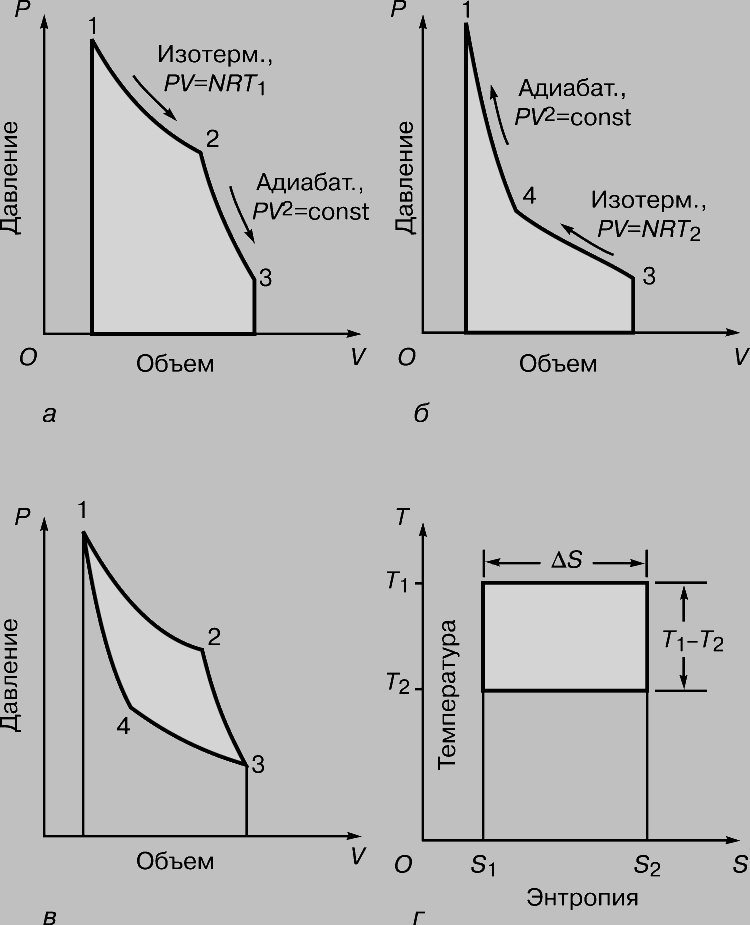 Рис. 3. ЦИКЛ КАРНО на диаграмме объем — давление. Площади, выделенные ретушью: а — работа, совершаемая газом; б — работа, совершаемая над газом; в — разность площадей а и б, равная полезной работе, совершаемой машиной; г — диаграмма Молье, показывающая соотношение между теплотой
Рис. 3. ЦИКЛ КАРНО на диаграмме объем — давление. Площади, выделенные ретушью: а — работа, совершаемая газом; б — работа, совершаемая над газом; в — разность площадей а и б, равная полезной работе, совершаемой машиной; г — диаграмма Молье, показывающая соотношение между теплотой
Мерой полезной работы, совершенной машиной, является разность площадей (рис. 3,а и б), показанная на рис. 3,в. Нетрудно сообразить, что при заданном изменении объема эту разность площадей можно увеличить либо повысив T1, либо понизив T2. Если же температура T1 фиксирована (а это значит, что фиксировано полное количество подводимой теплоты), то работу, производимую машиной, можно увеличить, только понизив T2. С особой наглядностью это показывает "диаграмма Молье" (график зависимости температура — энтропия), представленная на рис. 3,г. Здесь тоже полезная работа пропорциональна выделенной площади; подводимая теплота определяется площадью T1DS, а часть ее, соответствующая площади прямоугольника T2DS, "бесполезна" в смысле совершения работы. Таким образом, какова бы ни была температура T1, отличная от абсолютного нуля, какая-то часть подводимой теплоты не может быть превращена в работу. На изложенных соображениях основан вывод формулы Карно, которая дает максимально возможный КПД идеальной тепловой машины, работающей при заданной разности температур нагревателя и холодильника: 
Реальная машина не может работать с таким КПД, поскольку в ней неизбежны трение и утечки тепла. Для паровой машины, работающей, например, при температуре котла 130° C (403 К) и температуре конденсатора 30° C (303 К), термодинамический КПД равен 100/403, т.е. меньше 25%.
Цикл холодильной машины. Поскольку рабочее тело в цикле Карно возвращается в исходное состояние, можно представить себе обращенную тепловую машину. Если в прямом цикле передача тепла от нагревателя к холодильнику используется для получения работы, то в обращенном за счет совершения механической работы теплота передается от холодильника нагревателю, так что холодильник становится еще холоднее, а нагреватель — еще горячее. Таков цикл холодильной машины (используемый, например, в холодильниках и кондиционерах): работа, совершаемая электродвигателем домашнего холодильника, идет на то, чтобы внутри холодильника было холодно за счет нагревания окружающего воздуха.
Другие циклы тепловой машины. В реальных тепловых машинах циклы с изотермическими процессами не находят применения, поскольку такие процессы требуют много времени. Предпочтение отдается адиабатическим процессам, ибо они ближе к реальности в быстро работающих машинах. Простейший из таких циклов — цикл Отто (рис. 4,а), названный по имени немецкого изобретателя и инженера Н. Отто (1832-1891). В этом цикле подводимая теплота повышает давление газа при постоянном объеме, а затем газ адиабатически расширяется с совершением полезной работы. После того как достигнут заданный объем, теплота отводится, а часть работы затрачивается на адиабатическое сжатие газа, после чего цикл может повториться. КПД определяется степенью сжатия r: 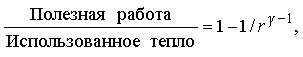
где g — отношение удельных теплоемкостей газа при постоянном давлении и при постоянном объеме. Чем больше r, тем больше КПД.
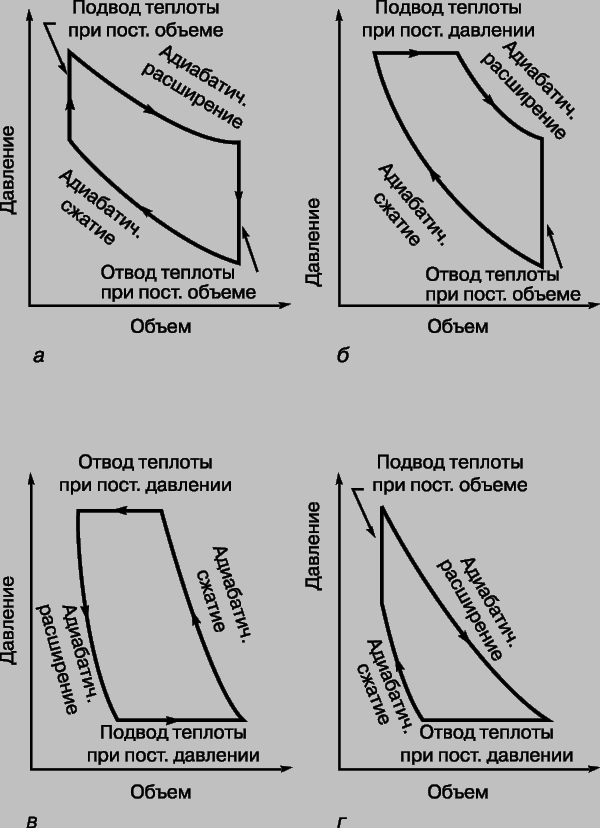 Рис. 4. ТЕОРЕТИЧЕСКИЕ ЦИКЛЫ ЧЕТЫРЕХ ТЕПЛОВЫХ МАШИН. а — цикл Отто; б — цикл Дизеля; в — цикл Джоуля; г — цикл Аткинсона.
Рис. 4. ТЕОРЕТИЧЕСКИЕ ЦИКЛЫ ЧЕТЫРЕХ ТЕПЛОВЫХ МАШИН. а — цикл Отто; б — цикл Дизеля; в — цикл Джоуля; г — цикл Аткинсона.
Цикл Дизеля (рис. 4,б) назван по имени немецкого изобретателя Р. Дизеля (1858-1913). В этом цикле теплота тоже отдается при постоянном объеме после адиабатического расширения, но подводится (после адиабатического сжатия) при постоянном давлении. В дизельном двигателе тепло не подводится от внешнего источника, а вырабатывается внутри при сгорании топлива, самовоспламеняющегося при сильном сжатии. Высокотемпературные газы не охлаждаются, а совершают работу и выводятся наружу с заменой холодной смесью топлива с воздухом. Теоретический цикл почти полностью воспроизводится, если не считать влияния механических факторов и других неизбежных тепловых потерь. В менее известном цикле Аткинсона (рис. 4,г) последовательность ветвей обратна последовательности в цикле Дизеля. Только в цикле Джоуля (рис. 4,в) теплота и отдается и подводится при постоянном давлении, но этот цикл обычно не используется для преобразования теплоты в работу; он применяется в обращенной (холодильной) машине. Графики зависимости давление — объем типа представленных на рис. 3 и 4 называются индикаторными диаграммами. Ими пользуются инженеры для расчета КПД двигателей. Для примера на рис. 5 представлена индикаторная диаграмма четырехтактного бензинового двигателя. За тактом сжатия CD, начинающимся в точке C, следуют сгорание топлива на вертикальной ветви DE и рабочий такт EF. В точке F открывается выпускной клапан, так что давление понижается до атмосферного давления PA, и отработанные газы выбрасываются из цилиндра двигателя соответственно горизонтальной ветви AB. На участке BўC в цилиндр впускается новая горючая смесь, и цикл заканчивается. В реальном двигателе сгорание не происходит мгновенно. Если зажигание производится в точке D, то пламя распространяется по цилиндру, когда объем уже начал увеличиваться, и поэтому максимальное теоретическое давление не достигается. Значительная часть площади, пропорциональной совершаемой работе, теряется, что показано штриховой линией DG. Если же зажигание производится с опережением, например в точке H, то теряется лишь малая часть полезной площади, как показано штриховой линией HI. Это объясняется тем, что при нарастании давления объем все еще продолжает уменьшаться.
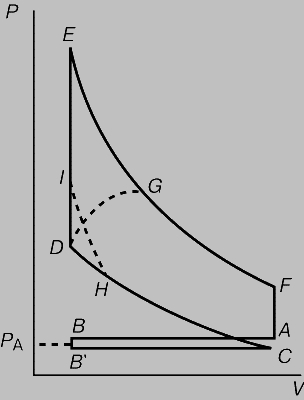 Рис. 5. ДИАГРАММА ОБЪЕМ — ДАВЛЕНИЕ четырехтактного бензинового двигателя.
Рис. 5. ДИАГРАММА ОБЪЕМ — ДАВЛЕНИЕ четырехтактного бензинового двигателя.
ТЕРМОДИНАМИЧЕСКИЕ ФУНКЦИИ
Внутренняя энергия. Когда к системе подводится некоторое количество теплоты dQ, за счет этой теплоты, как было показано ранее на примере цикла Карно, может быть совершена лишь определенная работа dW, так что часть полученной тепловой энергии система теряет. Эти две величины, вообще говоря, неодинаковы, и, следовательно, система либо теряет, либо приобретает энергию, равную их разности. Предположим, что эта разность энергий остается в системе в виде т.н. внутренней энергии E. Тогда последняя увеличится от E до (E + dE), причем 
где dQ и dW — бесконечно малые приращения. Вообще говоря, приращения dQ и dW не являются независимыми (почему они и обозначены здесь символом d в отличие от приращения dE). Так, поглощение теплоты обычно сопровождается изменением объема и, следовательно, совершением работы против внешнего давления. И наоборот, если допускается расширение, то оно обычно сопровождается поглощением теплоты, отбираемой у окружающей среды. Никакие ограничения, налагаемые реально на систему, не могут полностью исключить такого взаимодействия, но мысленно можно представить себе идеальную теплоизоляцию (dQ = 0) или строго выполняющееся условие постоянного объема (dW = 0), так же как в теоретической механике вводятся понятия идеально гладких и идеально твердых тел. Только в идеальных условиях, когда dQ и dW независимы друг от друга, приращение dQ или dW можно рассматривать как полный дифференциал, тогда как их разность dE всегда является таковой.
Энтропия. Тепловая энергия dQ', которая не может быть преобразована в работу, пропорциональна нижней температуре T, так что можно записать dQ' = TdS, где dS — приращение энтропии S системы. Как и E, величина S является характеристикой самой системы, а потому мы обозначаем ее приращение буквой d, а не d. Обозначив через dW работу, которую можно получить за счет теплоты dQ, можно написать 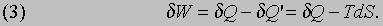
Если рабочее тело в результате некоего термодинамического процесса не возвращается в исходное состояние, то значительная часть энергии оказывается бесполезной с точки зрения совершения работы, и внутренняя энергия увеличивается на соответствующую разность dE. Увеличение внутренней энергии может проявиться в изменении физического состояния рабочего тела, например в переходе из твердого в жидкое состояние (плавлении) или из жидкого в газообразное (испарении). Такая тепловая энергия называется теплотой плавления и теплотой парообразования соответственно. Повышение внутренней энергии может быть связано также с химическими изменениями (диссоциацией, разрывом связей) и даже с делением ядер.
Энтальпия. Если изменения энергии системы происходят при постоянном давлении, то, как оказывается, функция 
позволяет придать более простую и изящную форму уравнениям, описывающим различные процессы. Дело в том, что при небольшом изменении состояния системы в силу равенств (1) и (2) можно записать 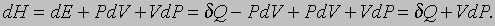
Следовательно, если процесс протекает при постоянном давлении (dP = 0), то выполняется равенство dH = dQ, т.е. подведенное количество теплоты может быть представлено в виде полного дифференциала некой величины, характеризующей внутреннее состояние системы. Эта величина называется энтальпией. Ранее она называлась тепловой функцией или теплосодержанием системы.
Свободная энергия. В изотермических условиях (dT = 0) более, чем H, удобна другая термодинамическая функция: 
Такие же выкладки, как и в случае энтальпии, дают dF = dW. Ранее величина F называлась свободной энергией Гельмгольца, поскольку именно Гельмгольц первым указал на ее значение, но сейчас ее называют просто свободной энергией.
Потенциал Гиббса. В тех случаях, когда изменяться могут и температура и давление, используется более общая функция 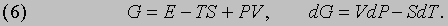
Эту функцию иногда называют полным термодинамическим потенциалом или полезной энергией, но сейчас ее принято называть потенциалом Гиббса или гиббсовой энергией и обозначать символом G по имени Дж. Гиббса (1839-1903). Как будет показано ниже, представленные термодинамические функции позволяют определить условия, необходимые для равновесия. В случае повышения давления на малую величину dP в системе, поддерживаемой при постоянной температуре (dT = 0), потенциал Гиббса увеличится на величину dG, а скорость его увеличения, или "чувствительность" потенциала Гиббса G к изменениям давления, дается термодинамическим выражением для объема системы 
где символ частной производной указывает на то, что изменение происходит при постоянных значениях всех других параметров (в данном случае температуры T). Точно так же чувствительность потенциала Гиббса к изменениям температуры (при постоянном давлении) есть мера энтропии системы: 
и это равенство можно рассматривать как еще одно определение энтропии. Соотношения между термодинамическими функциями. Величины E, H, F и G имеют размерность энергии, и любые три из них могут быть выражены через четвертую. Если dW = PdV, то, пользуясь равенствами (7) и (8), можно H, F и E выразить через G: 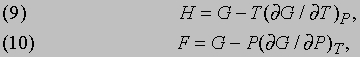
а следовательно, 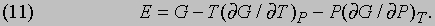
Если считать функцией только G, то из независимых переменных достаточно будет рассматривать лишь P и T, что почти всегда оказывается наиболее удобным. Если же в качестве единственной функции выбрать E, то самыми удобными с математической точки зрения будут независимые переменные V и T или V и S, но последняя из них, очевидно, не очень удобна для прямых измерений.
Теплоемкость. Изменение энтропии dS вещества можно вычислить по количеству теплоты, необходимому для повышения его температуры на один градус, т.е. по измеренной теплоемкости C. Но теплоемкость зависит от того, может ли вещество расширяться при постоянном давлении P, так как тогда за счет теплоты должна совершаться работа, связанная с расширением. Поэтому теплоемкость при постоянном давлении CP больше теплоемкости при постоянном объеме CV. Эти величины даются равенствами 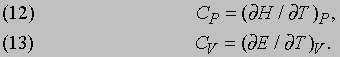
Разность теплоемкостей CP и CV выражается в тепловых единицах, а избыточная энергия, необходимая для совершения работы при расширении против сил давления, может быть выражена в механических единицах [[см. формулу (2) и рис. 1]]. Именно так Майер и вычислил механический эквивалент теплоты.
Вычисление энтропии. Если давление P постоянно, то, поскольку H = E + PV, с учетом равенства (3) можно написать 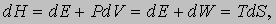
откуда 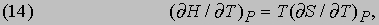
или 
Следовательно, построив график зависимости отношения CP/T от T (или, что с математической точки зрения то же самое, график зависимости CP от ln T), можно найти приращение энтропии DS как площадь кривой на графике (рис. 6): 
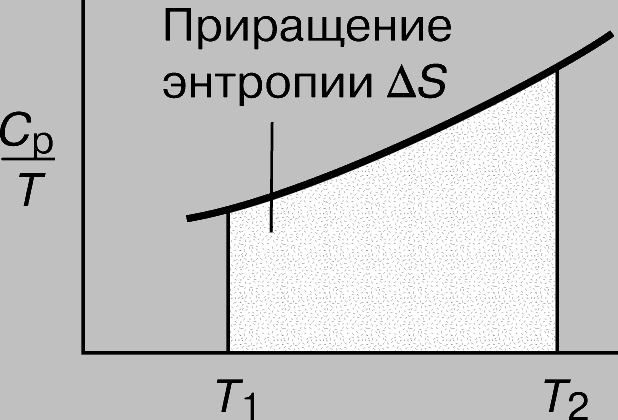 Рис. 6. ПРИРАЩЕНИЕ ЭНТРОПИИ как рост неупорядоченности системы.
Рис. 6. ПРИРАЩЕНИЕ ЭНТРОПИИ как рост неупорядоченности системы.
Неупорядоченность и энтропия. Австрийский физик Л.Больцман показал, опираясь на статистическую механику, что энтропия есть мера неупорядоченности, а именно: 
где S — энтропия N молей вещества, а R — постоянная из общего уравнения для газов 
которое представляет собой математическую запись отдельных законов, открытых Р. Бойлем (1627-1691) и Э. Мариоттом (1620-1684) и объединенных Ж. Гей-Люссаком (1778-1850) с законом, установленным Ж. Шарлем (1746-1823). Универсальная газовая постоянная R для всех газов равна 8,3144 Дж/моль*К. Величина F — это число способов, которыми энергия может быть распределена среди молекул при данной температуре, отнесенное к соответствующему числу способов при абсолютном нуле температуры. Если температура выше абсолютного нуля, то система стремится перейти в состояние, в котором величина Ф больше, так как в этом случае будет меньше энергия, приходящаяся на каждую молекулу, а это более вероятная ситуация, нежели распределение, при котором вся энергия приходится на небольшое число молекул. Таким образом, энтропия вещества, находящегося в данном состоянии, есть относительная вероятность этого состояния, взятая в логарифмическом масштабе и умноженная на NR, для того чтобы она выражалась в термодинамических единицах. Идеальный кристалл со строго упорядоченным расположением всех атомов — очень маловероятная структура, которая может поддерживаться лишь при наличии больших межатомных сил или, иначе говоря, при низком уровне его внутренней энергии. При нагревании кристалла тепловое движение нарушает эту упорядоченность. При определенной температуре (точке плавления), когда тепловая энергия становится больше энергии межатомного взаимодействия, твердая кристаллическая решетка разрушается и вещество переходит в менее упорядоченное жидкое состояние. Свободная энергия, которой характеризуется равновесное состояние [[формула (5)]], определяется соотношением между упорядочивающим действием внутренней энергии и разупорядочивающим действием повышенной температуры, причем энтропия служит количественной мерой действия температуры.
Равновесие. Таким образом, условием равновесия при постоянной внутренней энергии является максимум энтропии S. Возможны некоторые флуктуации, кратковременно выводящие систему из этого состояния, но в среднем за любое достаточно длительное время выполняется равенство dS = 0. Поскольку величины F и G являются функциями энтропии S, взятой со знаком "минус", данное условие означает, что равновесие возможно только тогда, когда либо величина F, либо величина G имеет минимум. Таким образом, при любом мыслимом изменении dX условия равновесия таковы: 
или

Аналогично 
или

Изменение dX может представлять собой увеличение объема, уменьшение площади поверхности, сокращение длины, увеличение электрического заряда, уменьшение намагниченности или увеличение числа молекул. Энергетическая функция тогда должна иметь еще более общую форму, нежели потенциал Гиббса G, а для того, чтобы равновесие было устойчивым, все другие переменные — внутренняя энергия, энтропия, температура, давление, поверхностное натяжение, электрический потенциал, напряженность магнитного поля, химический потенциал — должны изменяться в строгом согласии с уравнением (20). Такова обобщенная формулировка принципа динамического равновесия, установленного в 1884 французским химиком А. Ле Шателье (1850-1936). Введенный им принцип гласит: "Если на систему, находящуюся в устойчивом равновесии, оказывается внешнее воздействие, то в системе происходит такое смещение равновесия, которое ослабляет это воздействие".
Термодинамические соотношения. Дифференцируя уравнения, связывающие термодинамические функции между собой, и привлекая другие фундаментальные законы, можно вывести некоторые важные соотношения между такими функциями. 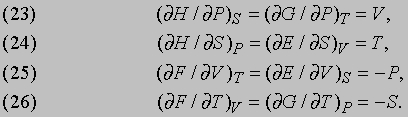
Уравнения (23)-(25) лучше проясняют физический смысл функций E, H, F и G в их связи с более привычными переменными V, T и P. Уравнение же (26), как уже говорилось, дает еще одну интерпретацию энтропии S с использованием функции F или G. Дж.Максвелл (1831-1879) вывел следующие важные соотношения между переменными V, T, P и S: 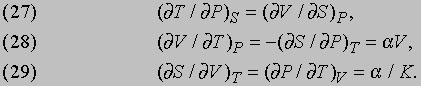
Здесь a — коэффициент теплового расширения, отнесенный к единице объема при постоянном давлении, т.е. (1/V)(dV/dТ)P, а K — изотермическая сжимаемость -(1/V)(dV/dP)T.
Применение соотношений Максвелла. Из соотношений Максвелла можно вывести другие интересные соотношения. Например, можно вычислить теплоту парообразования L некоторой жидкости, чтобы выяснить, как она зависит от изменения объема при испарении. В первой части двойного равенства (29) величину S можно приравнять L/T. Изменение объема dV равно разности (V- v) объема пара V и объема жидкости v при температуре T, которая в данном случае, конечно, равна точке кипения жидкости при нормальном атмосферном давлении P. Следовательно, 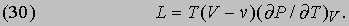
Это соотношение было выведено путем анализа теплового цикла, предложенного французским инженером Б. Клапейроном (1799-1864) в 1834. Оно показывает, что теплоту парообразования необязательно определять калориметрическими методами; ее можно вычислить по расширению, происходящему при испарении, если известна скорость повышения давления насыщенного пара жидкости при повышении температуры, когда поддерживается постоянным объем системы. Это типичное уравнение термодинамики, устанавливающее соотношение между казалось бы не связанными друг с другом переменными. Путем аналогичных рассуждений Р. Клаузиус (1822-1888) вывел выражение для разности теплоемкостей Cs твердой и Cl жидкой фаз: 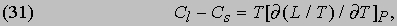
которое, впрочем, проще вывести из соотношения (15). Поскольку он рассматривал уравнение Клапейрона и внес, по его словам, "небольшие изменения" в ход рассуждений, за соотношением (30) укрепилось название уравнения Клаузиуса — Клапейрона. Рассуждая в какой-то мере аналогично, можно, пользуясь первым из соотношений Максвелла, вывести формулу, показывающую влияние давления на температуру плавления твердого вещества, теплоизолированного так, что его энтропия постоянна: 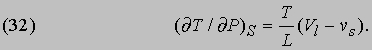
Здесь L — теплота плавления, T — температура плавления при данном давлении P, а (Vl — vs) — изменение объема твердого вещества при плавлении. В случае льда при плавлении происходит сжатие, и формула (32) показывает, что с повышением давления температура плавления понижается. Опытные данные согласуются с результатами вычислений. Большинство других твердых веществ при плавлении расширяется, и, следовательно, их температуры плавления повышаются с повышением давления.
Влияние давления. Другие эффекты, связанные с изотермическим изменением давления, описываются формулами 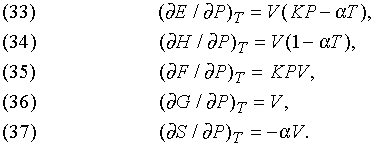
Эффект Джоуля — Томсона. Если газ находится в теплоизолированном сосуде и над ним не совершается работа (H = const), то изменение его температуры, обусловленное изменением давления, дается формулой 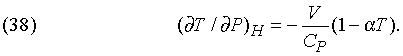
Для идеального газа aT = 1, и поэтому его температура не должна изменяться. Следовательно, по изменению температуры, измеренному, например, при расширении газа в вакуум, можно оценивать степень отклонения реального газа от идеального. Такой эффект действительно наблюдается, и по имени ученых, открывших его, называется эффектом Джоуля — Томсона.
Влияние температуры. Точно так же выводятся формулы, описывающие влияние температуры при постоянном давлении: 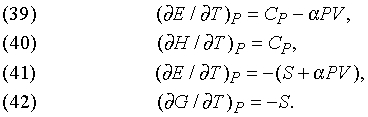
Другие соотношения. Разность теплоемкостей при постоянном давлении и при постоянном объеме дается выражением 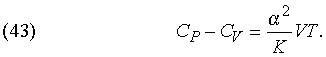
Выражение для скорости с звука в газе имеет вид 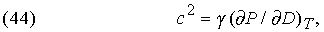
где D — плотность газа, а g = CP /CV. Многое можно рассчитывать графическими методами на основе экспериментальных данных, не делая никаких предположений об аналитических соотношениях между величинами. Но в тех случаях, когда имеются алгебраические выражения, описывающие рассматриваемые явления, окончательные результаты часто удается получить простым дифференцированием и интегрированием. Например, в диапазоне от абсолютного нуля до некоторой предельной температуры, для каждого вещества своей, теплоемкость всех веществ при постоянном объеме пропорциональна кубу температуры (по шкале Кельвина): 
Это выражение вывел на основе квантовой теории П.Дебай (1884-1966). Оно позволяет простым интегрированием вычислять полную энтропию при температурах, близких к 0 К: 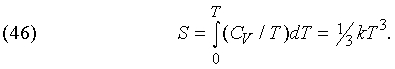
Уравнения состояния. Благодаря своей простой форме газовый закон [[формула (18)]] позволяет делать важные выводы о свойствах идеального газа. Но при адиабатическом сжатии идеальный газ нагревается. В этом случае изотермический закон PV = NRT не выполняется, и его необходимо заменить уравнением 
где g — отношение удельных теплоемкостей при постоянном давлении и при постоянном объеме, т. е. g = CP /CV. Это уравнение вывел французский математик С. Пуассон (1781-1840). В рабочих цилиндрах тепловых машин (паровых машин, бензиновых, газовых и дизельных двигателей) скорость сжатия велика, но процесс не является полностью адиабатическим и называется политропным. При решении большинства проектно-конструкторских задач в таких случаях принимается уравнение вида 
где n — постоянная величина, меньшая чем g, и ее превышение над единицей зависит от быстроты сжатия. Кроме того, поведение реальных газов отклоняется от уравнений (18), (47) и (48), и для них используются т.н. уравнения состояния. Примером таких уравнений может служить 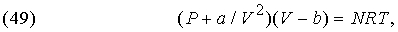
где a и b — константы, зависящие от природы газа. Это уравнение вывел Я.Ван-дер-Ваальс (1837-1923). Было предложено немало и других уравнений; некоторые из них справедливы только для одного газа.
ЛИТЕРАТУРА
Бэр Г. Техническая термодинамика. М., 1973 Базаров И.П. Термодинамика. М., 1983 Вукалович М.П., Новиков И.И. Термодинамика. М., 1984 Квасников И.А. Введение в теорию квазистатических процессов. М., 1986
Значения в других словарях
- ТЕРМОДИНАМИКА — Наука о наиб. общих св-вах макроскопич. физ. систем, находящихся в состоянии термодинамич. равновесия, и о процессах перехода между этими состояниями. Т. строится на основе фундам. принципов (начал), к-рые явл. обобщением многочисл. Физический энциклопедический словарь
- Термодинамика — Наука о наиболее общих свойствах макроскопических систем, находящихся в состоянии термодинамического равновесия, и о процессах перехода между этими состояниями. Большая советская энциклопедия
- термодинамика — -и, ж. Раздел физики, изучающий законы теплового равновесия и превращения теплоты в другие виды энергии. Малый академический словарь
- термодинамика — орф. термодинамика, -и Орфографический словарь Лопатина
- термодинамика — Терм/о/дина́м/ик/а. Морфемно-орфографический словарь
- термодинамика — ТЕРМОДИНАМИКА, см. химическая термодинамика. Химическая энциклопедия
- ТЕРМОДИНАМИКА — ТЕРМОДИНАМИКА, раздел физики, изучающий ТЕПЛОТУ и процессы ее превращения в другие виды ЭНЕРГИИ, а также обратные процессы. В общем виде термодинамическую систему характеризует температура, объем, давление и химический состав. Научно-технический словарь
- термодинамика — ТЕРМОДИНАМИКА [те] и [тэ], -и; ж. 1. Раздел физики, изучающий законы теплового равновесия и превращения теплоты в другие виды энергии. Законы термодинамики. Прикладная т. // Учебный предмет, излагающий этот раздел. Читать термодинамику. Толковый словарь Кузнецова
- термодинамика — ТЕРМОДИНАМИКА, и, ж. Раздел физики, изучающий закономерности теплового движения и его влияние на свойства физических тел. | прил. термодинамический, ая, ое. Толковый словарь Ожегова
- Термодинамика — См. Теплота. Энциклопедический словарь Брокгауза и Ефрона
- термодинамика — Термодинамики, мн. нет, ж. [от греч. therme – теплота и слова динамика] (физ.). Наука, изучающая превращение теплоты в иные виды энергии. Большой словарь иностранных слов
- ТЕРМОДИНАМИКА — ТЕРМОДИНАМИКА (от термо... и динамика) — раздел физики, изучающий наиболее общие свойства макроскопических систем, находящихся в состоянии термодинамического равновесия, и процессы перехода между этими состояниями. Большой энциклопедический словарь
- термодинамика — термодинамика ж. 1. Раздел физики, изучающий законы теплового движения, влияние теплового движения на физические свойства тела и превращение теплоты в другие виды энергии. 2. Учебный предмет, содержащий теоретические основы данного раздела физики. Толковый словарь Ефремовой
- термодинамика — ТЕРМОДИН’АМИКА, термодинамики, мн. нет, ·жен. (от ·греч. therme — теплота и слова динамика) (физ.). Наука, изучающая превращение теплоты в иные виды энергии. Законы термодинамики. Толковый словарь Ушакова
