Гидролиз
Гидро́лиз
(от Гидро... и греч. lýsis — разложение, распад)
реакция ионного обмена между различными веществами и водой. В общем виде Г. можно представить уравнением:
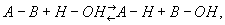
где А—В — гидролизующееся вещество, А—Н и В—ОН — продукты Г.
Равновесие в процессе Г. солей подчиняется Действующих масс закону. Если в результате Г. образуется нерастворимое или легколетучее вещество, Г. идёт практически до полного разложения исходной соли. В остальных случаях Г. солей проходит тем полнее, чем слабее соответствующая соли кислота или основание.
Если Г. подвергается соль, образованная слабой кислотой и сильным основанием, например KCN, раствор имеет щелочную реакцию; это объясняется тем, что анион слабой кислоты частично связывает образовавшиеся при диссоциации воды ионы Н+ и в растворе остаётся избыток ионов OH-:
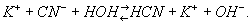
Раствор соли сильной кислоты и слабого основания, например NH4Cl, — кислый
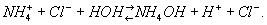
Если заряд катиона (или аниона) соли больше единицы, то Г. часто приводит к образованию кислых (или основных) солей в качестве продуктов первой ступени процесса, например:
CuCl2 → Cu (OH) Cl → Cu (OH)2.
Количественной характеристикой Г. солей может служить степень гидролиза (α), определяемая отношением концентрации гидролизованной части молекул к общей концентрации данной соли в растворе; в большинстве случаев она невелика. Так, в 0,1 молярных растворах ацетата натрия CH3COONa или хлорида аммония NH4CI при 25 °С α = 0,01%, а для ацетата аммония CH3COONH4 α = 0,5%. С повышением температуры и разбавлением раствора степень Г. увеличивается.
Г. солей лежит в основе многих важных процессов в химической промышленности и лабораторной практике. Частичный Г. трёхкальциевого силиката является причиной выделения свободной извести при взаимодействии портландцемента с водой (см. Цемент). Благодаря Г. возможно существование буферных систем (См. Буферные системы), способных поддерживать постоянную кислотность среды. Такие растворы имеют и очень важное физиологическое значение — постоянная концентрация ионов Н+ необходима для нормальной жизнедеятельности организма. С Г. солей связан ряд геологических изменений земной коры и образование минералов, формирование природных вод и почв.
Гидролиз органических соединений — расщепление органического соединения водой с образованием двух или более веществ. Обычно Г. осуществляется в присутствии кислот (кислотный Г.) или щелочей (щелочной Г.). Гидролитическому расщеплению чаще всего подвергаются связи атома углерода с другими атомами (галогенами, кислородом, азотом и др.). Так, щелочной Г. галогенидов служит методом получения (в том числе и промышленного) спиртов и фенолов, например:
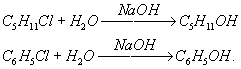
В зависимости от строения углеводородного радикала (R) и от условий реакции Г. галогенпроизводных может осуществляться как мономолекулярный (SN1) или бимолекулярный (SN2) процесс. В случае мономолекулярной реакции (См. Мономолекулярные реакции) вначале происходит ионизация связи углерод — галоген, а затем образующийся ион карбония реагирует с водой; щёлочь, если она добавлена, не влияет на скорость Г. и служит только для нейтрализации выделяющейся галогеноводородной кислоты и смещения равновесия:
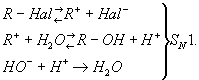
В случае бимолекулярной реакции (См. Бимолекулярные реакции) скорость Г. прямо пропорциональна концентрации щёлочи:
R—Hal+ + HO- → R—OH + Hal-SN2.
Исключительно важен Г. сложных эфиров (реакция, обратная этерификации):
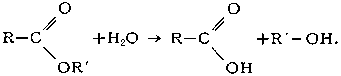
Кислотный Г. сложных эфиров является обратимым процессом:
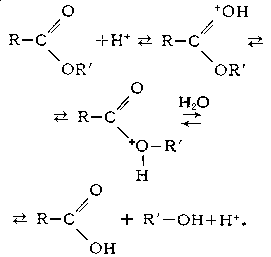
Щелочной Г. сложных эфиров необратим, поскольку он приводит к образованию спирта и соли кислоты:
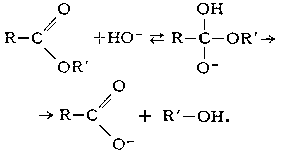
Этот процесс широко применяется в промышленности для получения спиртов и кислот, например при омылении жиров с целью получения глицерина и солей высших алифатических кислот (мыла).
Аналогично сложным эфирам гидролизуются амиды кислот:
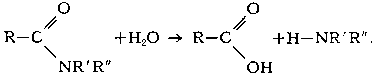
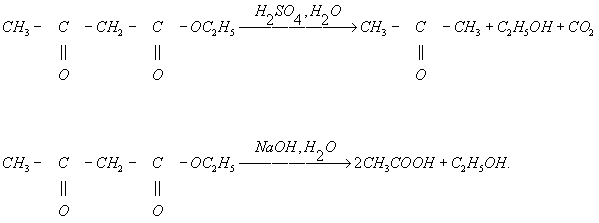
Случаи Г. углерод-углеродной связи сравнительно редки. К ним относятся, в частности, кетонное (действием кислот и разбавленных щелочей) и кислотное (действием концентрированной щёлочи) расщепление 1,3-дикарбонильных соединений, например ацетоуксусного эфира:
Термин «Г.» обычно применяется в органической химии также по отношению к некоторым процессам, которые более правильно было бы называть гидратацией (См. Гидратация); примером может служить превращение нитрилов кислот в амиды:
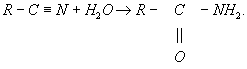
Г. сложноэфирных, гликозидных (в углеводах) и амидных (в белках) связей играет огромную роль в жизнедеятельности любых организмов, например, в таких процессах, как усвоение пищи, передача нервных импульсов и т. п. Г. в живом организме катализируется ферментами гидролазами (См. Гидролазы). См. также Гидролиз растительных материалов.
Лит.: Киреев В. А., Курс физической химии, 2 изд., М., 1956; Реутов О. А., Теоретические проблемы органической химии, 2 изд., М., 1964.
Значения в других словарях
- гидролиз — -а, м. хим. Разложение сложного вещества под воздействием воды. [От греч. ‛ύδωρ — вода и λύσις — разложение, распад] Малый академический словарь
- гидролиз — Гидролиз — химическое взаимодействие вещества с водой, сопровождающееся распадом сложного химического тела на составляющие его части и присоединением к ним ионов воды (Н+ и OH-). Обычно при гидролизе образуется два-три, а иногда и больше новых соединений. Толковый словарь по почвоведению
- гидролиз — орф. гидролиз, -а Орфографический словарь Лопатина
- гидролиз — ГИДРОЛИЗ (от греч. hydor — вода и lysis — разложение, распад) обменная реакция между веществом и водой. Количественно Г. характеризуют константой Г. (константой равновесия реакции... Химическая энциклопедия
- гидролиз — ГИДРОЛИЗ а, м. hydrolyse f. Реакция ионного обмена между веществами и водой. БАС-2. — Лекс. Гранат: гидролиз; Уш. 1935: гидролиз; БСЭ-2: гидролизный. Словарь галлицизмов русского языка
- гидролиз — Гидр/о́/лиз/. Морфемно-орфографический словарь
- ГИДРОЛИЗ — ГИДРОЛИЗ, химическая реакция разделения молекул вещества при взаимодействии с водой. Часто происходит в присутствии КАТАЛИЗАТОРА. Например, при пищеварении ФЕРМЕНТЫ катализируют ГИДРОЛИЗ УГЛЕВОДОВ, БЕЛКОВ и ЖИРОВ, и образуются молекулы, которые легко усваиваются организмом. Научно-технический словарь
- Гидролиз — I Гидролиз (греч. hydōr вода + lysis разложение; синоним: гидролитическое расщепление, гидролитическая деструкция) химическая реакция между каким-либо веществом и водой. Медицинская энциклопедия
- гидролиз — ГИДРОЛИЗ -а; м. [от греч. hydōr — вода и lysis — разложение, отделение]. Хим. Реакция ионного обмена между веществами и водой. Кислотный, щелочной г. ◁ Гидролизный, -ая, -ое. Г. завод. Г. спирт (полученный с помощью гидролиза). Толковый словарь Кузнецова
- гидролиз — ГИДРОЛИЗ, а, м. (спец.). Реакция обменного разложения соединений с водой. | прил. гидролизный, ая, ое. Толковый словарь Ожегова
- гидролиз — Гидролиза, м. [гидро и lysis – развязывание] (хим.). Химическое разложение нек-рых веществ действием воды. Большой словарь иностранных слов
- гидролиз — ГИДР’ОЛИЗ, гидролиза, ·муж. (от ·греч. hydor — вода и lysis — развязывание) (·хим. ). Химическое разложение некоторых веществ действием воды. Толковый словарь Ушакова
- гидролиз — гидролиз м. Реакция ионного обмена между веществами и водой. Толковый словарь Ефремовой
- ГИДРОЛИЗ — ГИДРОЛИЗ (от гидро... и...лиз) — обменная реакция (обменное разложение) между веществом и водой, напр., AlCl3 + 3H2O ? Al(OH)3 + 3HCl. Основа многих технологических и природных процессов. Большой энциклопедический словарь
- Гидролиз — (хим.). — Г., или, неправильно, гидролитической "диссоциацией", называется реакция разложения (ср. Вытеснение) водой тела, в ней растворенного (система... Энциклопедический словарь Брокгауза и Ефрона
