ε-капролактам
ε-КАПРОЛАКТАМ (гексагидро-2-азепинон, лактам ε-аминокапроновой кислоты, 2-оксогексаметиленимин)
мол. м. 113,16; бесцв. гигроскопич. кристаллы, т. пл. 68,8 °C, т. кип. 262,5 °C; плотн. при 70 °C 1,02 г/см3; nD70 1,4790, nD20 (50%-ный водный раствор) 1,4795; vкрит 339,5∙10−6 м3/моль, tкрит 750 и 805,7 К,
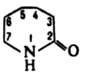
pкрит 47,62∙105 Па; температурный коэф. объемного расширения 0,00104 К−1 (80 90 °C); С0p при 60 и 70 °C соотв. 1,67 и 1,76 кДж/(кг∙К); ΔH0обр −269,63 кДж/моль, ΔH0сгор −3605,2 кДж/моль; S0298 1,49 Дж/(моль∙К). Уравнения температурной зависимости давления пара: для твердого (308–333 К) lgp (мм рт. ст.) = 13,06 + 4,73∙10−3/T, жидкого (353-413К) lgp (мм рт. ст.) = 6,78 + 2344/T; η 0,009 и 0,0047 Па∙с соотв. при 78 и 100 °C; γ 33,4∙10−3 Н/м (130 °C); теплопроводность 0,2326 Вт/(м∙К); ε 74 (20 °C, 20%-ный водный раствор). К. хорошо раств. в воде, органических растворителях и в разб. H2SO4; теплота растворения в воде 35,17 Дж/кг, в конц. H2SO4 611,27 Дж/кг (298–305 К). По химическим свойствам К. — типичный представитель лактамов. При нагр. с конц. минеральными кислотами образует соли; в присутствии небольших количеств воды, спиртов, аминов, карбоновых кислот при 250–260 °C полимеризуется с образованием полиамидной смолы, из которой затем получают волокно капрон (см. поли-ε-капроамид). В промышленности К. получают из бензола, фенола или толуола по схемам:
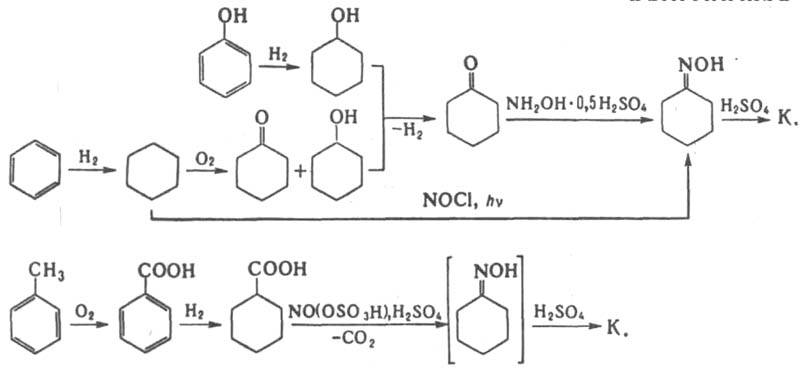
В промышленности наиб. распространение получил метод синтеза К. из бензола. Технол. схема включает гидрирование бензола в циклогексан в присутствии Pt/Al2O3 или никель-хромового катализатора при 250–350 и 130–220 °C, соответственно. Жидкофазное окисление циклогексана в циклогексанон осуществляют при 140–160 °C, 0,9–1,1 МПа в присутствии нафтената или стеарата Со. Получающийся в результате окисления циклогексанол превращают в циклогексанон путем дегидрирования на цинк-хромовых (360–400 °C), цинк-железных (400 °C) или медь-магниевых (260–300 °C) смешанных катализаторах. Превращение в оксим проводят действием избытка водного раствора сульфата гидроксиламина в присутствии щелочи или NH3 при 0–100 °C. Завершающая стадия синтеза К. — обработка циклогексаноноксима олеумом или конц. H2SO4 при 60–120 °C (перегруппировка Бекмана). Выход К. в расчете на бензол 66–68%. При фотохим. методе синтеза К. из бензола циклогексан подвергают фотохим. нитрозированию в оксим под действием NOCl при УФ облучении. Метод синтеза К. из фенола включает гидрирование последнего в циклогексанол в газовой фазе над Pd/Al2O3 при 120–140 °C, 1–1,5 МПа, дегидрирование полученного продукта в циклогексанон и дальнейшую обработку как в методе синтеза из бензола. Выход 86–88%. Метод синтеза К. из толуола включает: окисление толуола при 165 °C в присутствии бензоата Со; гидрирование получающейся бензойной кислоты при 170 °C, 1,4–1,5 МПа в присутствии 5%-ной взвеси Pd на мелкодисперсном угле; нитрозирование циклогексанкарбоновой кислоты под действием нитрозилгидросульфата (нитрозилсерной кислоты) при 75 80 °C до К. — сырца. Некоторые стадии этой схемы недостаточно селективны, что приводит к необходимости сложной очистки получаемого К. Выход К. 71% в расчете на исходный продукт. Полученный любым из перечисл. методов К. предварительно очищают с помощью ионообменных смол, NaClO и KMnO4, а затем перегоняют. Побочный продукт производства (NH4)2SO4 (2,5–5,2 т на 1 т К.), который используется в сельском хозяйстве в качестве минер. удобрения. Известны также методы получения К. из неароматич. сырья (фурфурола, ацетилена, бутадиена, этиленоксида), которые не нашли пром. применения. Твердый К. транспортируют в бумажных пятислойных мешках с полиэтиленовым вкладышем, жидкий — в специально оборудованных цистернах с обогревом в атмосфере азота (содержание кислорода в азоте не должно превышать 0,0005%). Т. всп. 135 °C, т. самовоспл. 400 °C, ниж. предел воспламенения 123 °C; ЛД50 450 мг/м3 (мыши, вдыхание паров), ПДК 10 мг/м3. Раздражает кожу. К. применяют для получения поли-ε-капроамида. Объем мирового производства 2,7 млн.т/год (1985); из них из бензола получают 83,6%, из фенола — 12%, из толуола — 4,4% К.
Лит.: Производство капролактама. М., 1977.
П. А. Лупанов, В. Н. Громогласова
