Гелля — Фольгарда — Зелинского реакция
ГЕЛЛЯ — ФОЛЬГАРДА — ЗЕЛИНСКОГО РЕАКЦИЯ (реакция Хелля — Фольхарда — Зелинского)
получение α-галоген-замещенных карбоновых кислот и их производных галогенированием кислот бромом (реже хлором) в присутствии Р или его галогенидов:
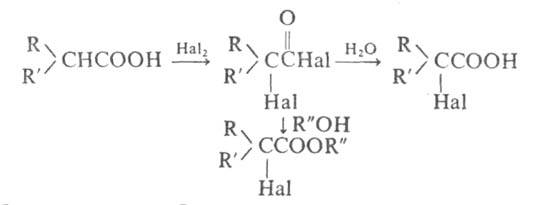
Обычно смесь карбоновой кислоты, Br2 и красного Р или РНа13 нагревают при 80–100 °C без растворителя. При использовании Р в стехиометрич. количествах образуются бромангидриды α-бромкарбоновых кислот, которые (часто без предварит. очистки) обрабатывают водой или спиртами для получения α- бромкарбоновых кислот или их эфиров. РBr5, образующийся в результате взаимод. Р с Br2, превращает кислоту в бромангидрид, который галогенируется легче, чем своб. кислота [вероятно, промежуточно образуется α-галогененол (формула
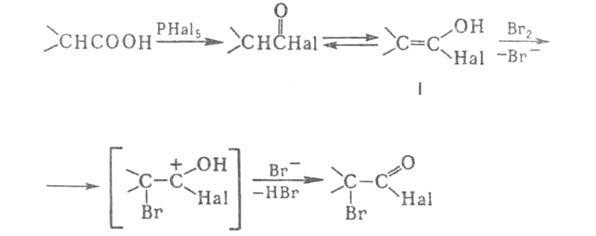
В случае применения лишь каталитич. количеств Р образующийся галогенангидрид α-галогенкарбоновой кислоты взаимод. с непрореагировавшей исходной кислотой, при этом регенерируется галогенангидрид незамещенной кислоты, который далее снова подвергается галогенированию:
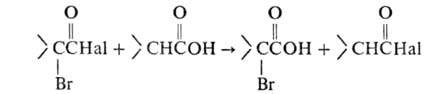
В результате α-галогенкарбоновую кислоту получают непосредственно (без обработки водой).
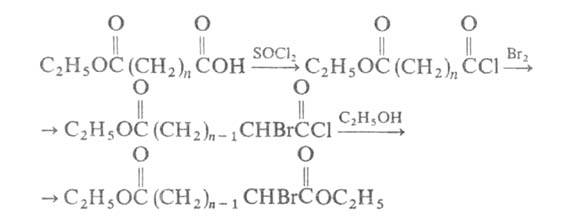
Часто для получения эфиров α-галогенкарбоновых кислот из исходной кислоты получают хлорангидрид действием SOCl2, хлорангидрид галогенируют Br2 или SO2C12 (иногда в присутствии следов I2); образующийся хлорангидрид α-галогенкарбоновой кислоты обрабатывают спиртом, напр.:
Выходы Г.-Ф.-З.р. достигают 80–90%. Из образующихся кислот или эфиров обычно синтезируют α-гидрокси-, α-амино- и α-меркаптокарбоновые кислоты. Реакция открыта К. М. Геллем в 1881 и усовершенствована Я. Фольгардом и Н. Д. Зелинским в 1887.
Лит.: Бюлер К., Пирсон Д., Органические синтезы, пер. с англ., ч. 1, М., 1973, с. 439–41.
Е. М. Рохлин
