Кнёвенагеля реакция
КНЁВЕНАГЕЛЯ РЕАКЦИЯ
конденсация карбонильных соед. с малоновой кислотой или с ее эфирами в присутствии вторичных аминов; в широком смысле — конденсация карбонильных соед. с веществами, содержащими активную метиленовую группу (напр., с β-дикетонами) в присутствии оснований:
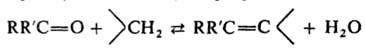
Исходные вещества обычно нагревают до температуры не выше 100 °C в этаноле, бензоле или пиридине. В качестве оснований используют NH3, RNH2, R2NH, KF, RbF, CsF. Иногда для проведения процесса достаточно простого смешения растворов реагентов без катализатора при комнатной температуре. В некоторых случаях, особенно при использовании в качестве веществ с активной метиленовой группой циануксусной кислоты или ее эфиров, реакцию проводят в присутствии пиперидина, β-аланина или CH3COONH4 с удалением образующейся H2O азеотропной перегонкой (модификация Коупа). Выходы К.р. достигают 60–80%. При взаимодействии алифатич. или ароматич. альдегидов с кислотами, содержащими в α-положении к карбоксильной группе активную метиленовую, в среде пиридина (часто с добавкой пиперидина) при 100 °C наряду с К. р. происходит декарбоксилирование (модификация Дёбнера ), напр.:
CH3CHO+CH2(COOH)2:CH3CH=CHCOOH+CO2+H2O
C6H5CHO+CH2(CN)COOH:C6H5CH=CHCN+CO2+H2O
Если в α-положении к карбонильной группе находится заместитель с сильным отрицат. индуктивным эффектом, образуются гидроксикислоты, напр.:
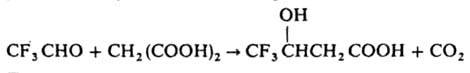
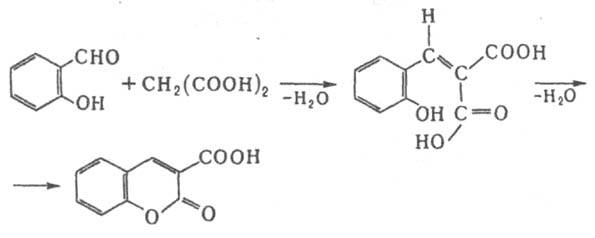
При взаимодействии альдегидов с малоновой или алкилмалоновыми кислотами в спиртовом растворе в присутствии NH3 или RNH2 побочно образуются р-аминокислоты, которые при избытке катализатора могут стать основными продуктами реакции. Используя К. р., можно получить гетероциклич. соед., напр.:
Механизм К. р. включает отрыв от метиленовой группы под действием основания (В) протона и послед. его перенос к промежут. соединениям:
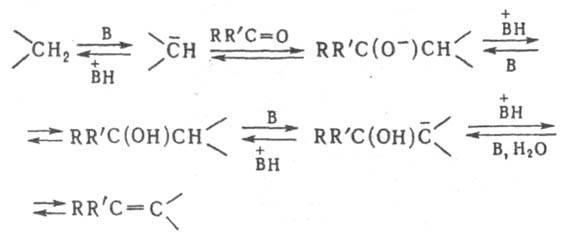
Первая стадия протекает быстрее последующих. Кинетика реакции обычно описывается уравнением второго порядка. К. р. широко применяют для синтеза пестицидов, красителей, лекарственных средств и мономеров. Она открыта Э. Кнёвенагелем в 1896.
Лит.: Серрей А., Справочник по органическим реакциям, пер. с англ., М., 1962, с. 150 52; Jones G., "Organic Reactions", 1967, v. 15, p. 204 599. С К. Смирнов.
