Коновалова реакция
КОНОВАЛОВА РЕАКЦИЯ
замещение атома Н в алифатич. и алициклич. соед., а также в боковой цепи жирноароматич. соед. на нитрогруппу при нитровании разб. азотной кислотой (жидкофазное нитрование):
RH+HNO3:RNO2+H2O
К. р. осуществляют при повышенном или нормальном давлении. Скорость реакции и выход нитросоед. зависят от температуры, концентрации HNO3, строения исходного соединения. Обычно используют 7–70 %-ную HNO3. Если замещение осуществляется у асимметрич. атома С, происходит образование оптически активных нитросоединений. Оптимальная температура нитрования предельных углеводородов 110–140 °C, концентрация НMO3 13,5%. Наиб. легко замещаются атомы Н у третичного атома С, труднее — у вторичного, наиб. трудно — у первичного. Алканы, содержащие третичные атомы С, нитруются с образованием значит. количества динитро- и тринитросоединений. Алициклич. углеводороды с третичным атомом С нитруются 9–10%-ной HNO3, незамещенные — 20%-ной. Нитрование жирно-ароматич. углеводородов протекает в α-положение боковой цепи, причем в осн. образуются мононитросоединения. Алхилгалогениды нитруются легче, чем соответствующие углеводороды. Первичные и вторичные алкилгалогениды при этом образуют нитросоединения, содержащие галоген, третичные отщепляют HHal с образованием непредельных углеводородов, которые могут подвергаться нитрованию. Спирты в условиях К. р. окисляются гл. обр. в кислоты, из альдегидов могут образовывать гем-динитросоединения. Нитрование кетонов приводит к динитрокетонам или к карбоновым кислотам и динитроалканам:
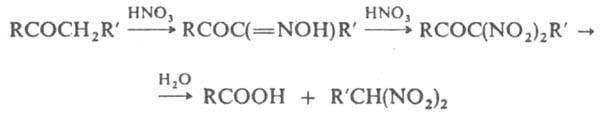
Действием сильно разб. HNO3 на карбоновые кислоты получают их нитропроизводные, действием более концентрированной — динитроалканы. Как и в случае углеводородов, в карбоновых кислотах легче всего замещение происходит при третичном атоме С. Основная побочная реакция процесса — окисление исходных соед.; др. побочные реакции — образование нитритов, нитрозососдинений и полинитросоединений. Модификации К. р. — нитрование в присутствии кислорода (модификация А. И. Титова) и парофазное нитрование углеводородов при атм. давлении и температуре 150–600 °C (реакция Хасса). В последнем процессе используют 35–70%-ную HNO3 при соотношениях углеводорода и кислоты (2–10):1; реакция промотируется следами O2 или галогенов. В интервале 250–450 °C при нитровании алканов образуются мононитропроизводные с тем же числом углеродных атомов, что и в исходном соед.; при более высоких т"рах наряду с нитрованием наблюдается расщепление алканов и образование нитросоед., содержащих меньшее число углеродных атомов, чем в исходном соединении. К. р. используют для пром. получения нитроалканов и нитроциклоалканов, а также в лаб. практике для установления строения углеводородов. О механизме реакции см. нитрование. Реакция открыта М.И. Коноваловым в 1888.
Лит.: Забродина А. С., Забродина К. С., в кн.: Реакции и методы исследования органических соединений, кн. 7, М., 1958, с. 133 222; Топчиев А. В., Нитрование, М., 1965; Химия алифатических и алициклнческих нитросоединений. М., 1974, с. 9–18; Перекалин В. В., СоповаА.С., Липина Э.С., Непредельные нитросоединения, 3 изд., Л., 1982.
Г. Л. Мищенко
Значения в других словарях
- Коновалова реакция — Замещение водорода нитрогруппой в алифатических или циклоалифатических соединениях, а также в боковой цепи жирно-ароматических соединений при прямом нитровании азотной кислотой: R-H+HNO3→RNO2+H2O. Собственно К. Большая советская энциклопедия
