ацетилен
АЦЕТИЛЕН (этин) (от лат. acetum — уксус и греч. hyle — лес, дерево; вещество) CH≡CH
мол. м. 26,04; бесцветный газ; т. пл. −81 °C/1277 мм рт. ст., т. возг. −84,1 °C; т. кип. −83,8 °C; плотн. 1,0896 г/л (газ; 20 °C; 101 кПа); Δ Н°о6р −227,400 кДж/моль (газ; 298,15 К), ΔH0сгор −1307 кДж/моль; Сpo 44,036 Дж/(моль∙К); давление пара жидкого А. (МПа): 1,1 ( −30 °C), 2,6 (0 °C), 5,4 (30 °C); tкрит 35,2 °C, pкрит 6,4 МПа; макс. температура кислородно-ацетиленового пламени 3150 °C (при содержании А. 45% по объему), воздушно-ацетиленовой смеси 2350 °C. Растворимость (объемы А.) в 1 объеме растворителя при 15 °C и 101 кПа: в воде-1,15; ацетоне-25 (при 1,2 МПа-300; при −80 °C и 0,1 МПа-2000); спирте-6; бензоле-4; уксусной кислоте-6 (18 °C); ДМФА −33,5 (25 °C).
Атомы углерода в А. sp-гибридизованы. Они связаны одной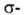 и двумя
и двумя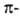 связями, макс. плотности которых расположены в двух взаимно перпендикулярных областях, образуя цилиндрич. облако
связями, макс. плотности которых расположены в двух взаимно перпендикулярных областях, образуя цилиндрич. облако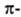 электронной плотности; за его пределами находятся атомы Н (см. рис.).
электронной плотности; за его пределами находятся атомы Н (см. рис.).
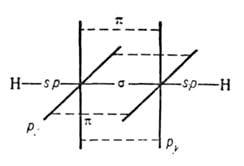
Молекула А. линейна; все 4 атома расположены на прямой. Расстояния C≡C и C—H равны соотв. 0,1205 и 0,1059 нм. Энергия тройной связи 836 кДж/моль. В ИК-спектрах несимметричной ацетиленовой группы (RC≡СН) имеются полосы поглощения валентных колебаний при частотах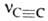 2260–2100 см−1, vС_H 3310–3300 см−1 и деформационных колебаний
2260–2100 см−1, vС_H 3310–3300 см−1 и деформационных колебаний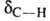 700–610 см'1. В спектрах ЯМР хим. сдвиг протона составляет 2,0 м. д., ядер 13С-68 м. д. (для C2H5G≡CH). Ацетиленовая группа не поглощает УФ-излучение с длиной волны более 200 нм.
700–610 см'1. В спектрах ЯМР хим. сдвиг протона составляет 2,0 м. д., ядер 13С-68 м. д. (для C2H5G≡CH). Ацетиленовая группа не поглощает УФ-излучение с длиной волны более 200 нм.
Для А. характерны реакции присоединения, которые происходят в две стадии: сначала образуются замещенные этилена, затем — замещенные алканов. Галогены присоединяются непосредственно, галогеноводороды — в присутствии катализаторов (напр., CuCl, HgCl2):
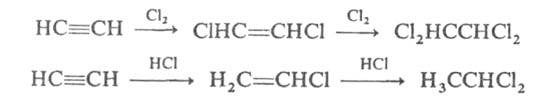
Эти реакции используются при производстве тетрахлорэтилена, трихлорэтилена, винилхлорида и др. хлорсодержащих соединений.
Водород присоединяется в присутствии катализаторов (Ni, Pt или др.): CH≡СН → CH2=CH2 → CH3CH3; вода — в присутствии солей Hg2+ с образованием ацетальдегида (Кучерова реакция). Прямая гидратация происходит при пропускании смеси А. и паров воды при 300–400 °C над фосфатами тяжелых металлов. Гидратация А. используется в промышленности для производства ацетальдегида и продуктов дальнейших его превращений — уксусной кислоты, ацетона, спирта. В присут. CuCl в кислой среде HCN присоединяется к А. с образованием акрилонитрила. А. легко присоединяет сулему в виде раствора в 10–12%-ной соляной кислоте:
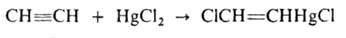
Действием AsCl3 на это соединение получают β-хлорвинилдихлорарсин (люизит):
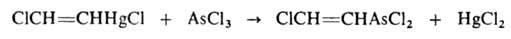
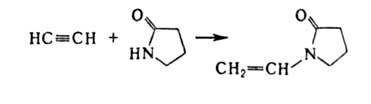
Спирты присоединяются к А. в присутствии КОН, BF3 или HgO при 150–200 °C Продукты реакции — простые виниловые эфиры, используемые в производстве полимеров, смазочных масел, эмульгаторов и др. Аналогично к А. могут присоединяться карбоновые кислоты (кат. — HgSO4, ацетаты Zn или Cd на активиров. угле), амины, амиды кислот, тиолы и др. с образованием виниловых соед., напр.:
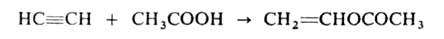
А. легко присоединяет альдегиды и кетоны в присутствии щелочных катализаторов (реакция Фаворского). Большое практическое значение имеет реакция А. с формальдегидом в присутствии ацетиленида Cu (реакция Реппе):
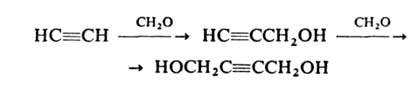
Образующиеся пропаргиловый спирт и 2-бутин-1,4-диол — исходные вещества в производстве 1,4-бутиленгликоля. При взаимодействии А. с CO и спиртами, NH3 или аминами в присутствии Ni(CO)4 под давлением получают эфиры или амиды акриловой кислоты, используемые в синтезе полимеров:
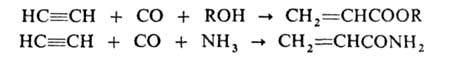
Карбонилирование м. б. использовано также для синтеза бензохинона:
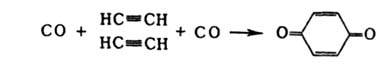
Под влиянием солей Cu(I) в водном HCl А. димеризуется в винилацетилен, из которого получают хлоропрен. Над активным углем А. гладко тримеризуется в бензол. В присут. Ni(CN)2 в тетрагидрофура не А. превращается в циклооктатетраен C8H8 (реакция Реппе), в присутствии H2 над Ni — в изобутилен.
Для А. характерны также реакции, обусловленные слабокислым характером ацетиленовой группы (pKа 25). При действии щелочных, щел.-зем. металлов (при нагревании, легче — в жидком NH3) или металлоорг. соед. образуются продукты замещения водорода в А. металлами, т. наз. ацетилениды МC≡CН, которые энергично реагируют с водой, регенерируя А. С магнийорг. соед. А. легко образует магнийгалогенопроизводные А. (реактивы Иоцича). Ацетилениды Mg, Na, Li часто используют в орг. синтезе для введения ацетиленовой группы. Так, при взаимодействии с алкилирующими агентами образуются алкилацетилены (напр., метилацетилен, 1-бутин, 1-пентин): RX + МC≡CH → RC≡СН + MX. Дизамещенные ацетилениды Cu2C2 и Ag2C2 образуются при действии на А. аммиачных растворов соотв. солей Cu(I) и Ag; эти ацетилениды взрывоопасны, напр. Cu2C2 взрывается около 120 °C. Образование Cu2C2 красного цвета часто используют для определения А.
25). При действии щелочных, щел.-зем. металлов (при нагревании, легче — в жидком NH3) или металлоорг. соед. образуются продукты замещения водорода в А. металлами, т. наз. ацетилениды МC≡CН, которые энергично реагируют с водой, регенерируя А. С магнийорг. соед. А. легко образует магнийгалогенопроизводные А. (реактивы Иоцича). Ацетилениды Mg, Na, Li часто используют в орг. синтезе для введения ацетиленовой группы. Так, при взаимодействии с алкилирующими агентами образуются алкилацетилены (напр., метилацетилен, 1-бутин, 1-пентин): RX + МC≡CH → RC≡СН + MX. Дизамещенные ацетилениды Cu2C2 и Ag2C2 образуются при действии на А. аммиачных растворов соотв. солей Cu(I) и Ag; эти ацетилениды взрывоопасны, напр. Cu2C2 взрывается около 120 °C. Образование Cu2C2 красного цвета часто используют для определения А.
• см. также ацетиленовые комплексы переходных металлов
При сжигании А. выделяется большое количество тепла. На этом основана ацетилено-кислородная сварка черных металлов (на сварку расходуется около 30% производимого А.).
А. — родоначальник ряда ацетиленовых углеводородов (см. табл.), хим. свойства которых также определяются наличием тройной связи C≡C. Методы получения А. в промышленности:
1. Разложение карбида кальция водой:
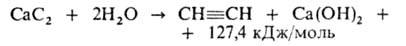
Поскольку реакция экзотермична, необходим строгий контроль за температурой, т. к. при перегреве А. легко разлагается, что может привести к взрыву. Используют генераторы производительностью до 2000 м3/ч. Примеси (NH3, PH3, AsH3, сульфиды и др.) удаляют окислением водными растворами NaCIO, FcCl3 или H2CrO4.
2. Электрокрекинг прир. газа (метана с примесью гомологов) в электродуговых печах:
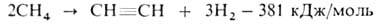
Метан пропускают между металлич. электродами при нормальном давлении, температуре 1600 °C, времени контакта доли секунды; смесь образовавшихся газов резко охлаждают водой. Полученный газ содержит 12–15% по объему А. (теоретически возможно 25%), который выделяют растворением в воде под давлением. Из 1000 м3 прир. газа получают 300 кг А., 26 кг этилена, 21 кг сажи и 1170 м3 H2. Расход электроэнергии ок. 9 кВт-ч на 1 кг неочищенного А. 3. Термоокислит. крекинг (частичное окисление) прир. газа благодаря теплу, выделяющемуся при частичном сгорании метана (CH4:O2 = 1 :0,65):
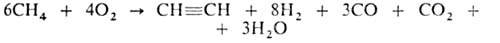
4. Пиролиз прир. газа. Над огнеупорной насадкой пропускают смесь газа с воздухом, которая, сгорая, нагревает насадку до ~ 1500 °C, а затем на насадке происходит пиролиз газа-метана, разбавленного обратным газом (после выделения А.) и водяным паром в соотношении 1:2:6. Операции повторяют многократно.
СВОЙСТВА АЦЕТИЛЕНОВЫХ УГЛЕВОДОРОДОВ
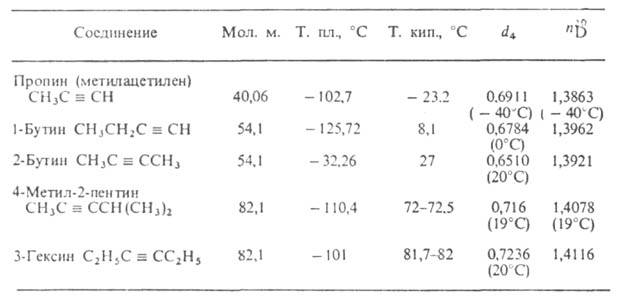
В газах, полученных методами 3 и 4, содержание А. редко достигает 20%. Выделить его из сложной смеси продуктов довольно трудно; чаще всего используют растворение в ДМФА или др. селективных растворителях. Экономич. затраты на производство А. термоокислит. крекингом и пиролизом вполне сравнимы с затратами по карбидному методу. Кроме того, эти методы выгодно отличаются от карбидного отсутствием прямого расхода электроэнергии и использованием в качестве сырья прир. газа. Производств. мощности по А. в промышленно развитых странах составляют сотни тысяч т/год.
А. взрывается при температуре ок. 500 °C или давлении выше 0,2 МПа; КПВ 2,3–80,7%, т. самовоспл. 335 °C Взрывоопасность уменьшается при разбавлении А. др. газами, напр. N2, метаном или пропаном. А. обладает слабым токсин, действием; ПДК 0,3 мг/м3. Хранят и перевозят его в заполненных инертной пористой массой (напр., древесным углем) стальных баллонах белого цвета (с красной надписью "А") в виде раствора в ацетоне под давл. 1,5–2,5 МПа. А. открыт Э.Дэви в 1836. Впервые синтезирован в 1862 М. Бертло из угля и H2.
Лит.: Ньюлэнд Ю.А., Фогт P.P., Химия ацетилена, пер. с англ., М., 1947; Федоренко Н. П.. Методы получения ацетилена. М.. 1958; Кононов Н. Ф.. Островский С. А.. Устынюк Л.А.. Новая технология некоторых синтезов на основе ацетилена, М., 1977; Котляревский И. Л., Карпицкая Л.Г., Химия ацетилена. Томск. 1981; Kirk-Othmer encyclopedia. 3 ed., v. 1, N. Y., 1978, p. 192–243; The chemistry of the carbon-carbon triple bond, ed. by S. Patai. N.Y.. 1978.
И. Л. Кнунянц
Значения в других словарях
- ацетилен — орф. ацетилен, -а Орфографический словарь Лопатина
- ацетилен — -а, м. Бесцветный горючий ядовитый газ с неприятным запахом, состоящий из углерода и водорода (применяется для сварки и резки металлов и в синтезе органических веществ). [От лат. acetum — уксус] Малый академический словарь
- Ацетилен — Ненасыщенный углеводород CH=CH; бесцветный газ. Температура плавления —81,8°С, затвердевает, минуя жидкое состояние; плотность 1,171 кг/м3 (при p = 103,3 кн/м2 = 760 мм рт. ст. и t = 0°C); мало растворим в воде, хорошо в ацетоне (при 15°C 25 объёмов... Большая советская энциклопедия
- ацетилен — АЦЕТИЛЕН а, м. acétylène m. <�лат. acet ( um ) — уксус и фр. ethylene. Бесцветный горючий газ с характерным запахом, применяемый при газовой сварке и резке металлов, для получения синтетических полимеров и. д. БАС-2. Словарь галлицизмов русского языка
- ацетилен — Ацет/ил/е́н/. Морфемно-орфографический словарь
- АЦЕТИЛЕН — АЦЕТИЛЕН, см. ЭТИН. Научно-технический словарь
- ацетилен — АЦЕТИЛЕН -а; м. [от лат. acetum — уксус]. Бесцветный горючий ядовитый газ с неприятным запахом (применяется для сварки и резки металлов, получения синтетических полимеров и т.д.). ◁ Ацетиленовый, -ая, -ое. А. запах. Толковый словарь Кузнецова
- ацетилен — ацетилен м. Бесцветный горючий газ с характерным запахом, применяемый при газовой сварке и резке металлов, для получения синтетических полимеров и т.п. Толковый словарь Ефремовой
- АЦЕТИЛЕН — АЦЕТИЛЕН — НС-СН, бесцветный газ, tкип = 84,1 °С. Получают из природных газов или карбида кальция. Сырье для синтеза винилхлорида, акрилонитрила, ацетальдегида, винилацетата и др.; горючее при сварке и резке металлов. Большой энциклопедический словарь
- ацетилен — АЦЕТИЛ’ЕН, ацетилена, мн. нет, ·муж. (от ·лат. acetum — уксус) (·хим., тех.). Горючий, бесцветный газ, состоящий из углерода и водорода. Толковый словарь Ушакова
- ацетилен — Ацетилена, мн. нет, м. [от латин. acetum – уксус] (хим., тех.). Горючий, бесцветный газ, состоящий из углерода и водорода. Большой словарь иностранных слов
- ацетилен — АЦЕТИЛЕН, а, м. Бесцветный горючий газ, соединение углерода с водородом. | прил. ацетиленовый, ая, ое. Толковый словарь Ожегова
- Ацетилен — Первый член группы ацетиленистых углеводородов, принадлежащей к ряду СnН2n — 2; химический состав его С2Н2, строение же В чистом состоянии А. получен и исследован Бертело в 1859... Энциклопедический словарь Брокгауза и Ефрона
