гидроксид-анион
ГИДРОКСИД-АНИОН OH−
Существует в газовой фазе изолированно, находится в кристаллич, решетке гидроксидов и основных солей наиб. активных металлов, образуется в водных растворах вследствие диссоциации воды или (и) растворенных гидроксдцов. Для OH− в газовой фазе: длина связи O—H 0,096 нм; частота колебаний 3800 см−1; энергия ионизации 176,13 кДж/моль; C0p 29,14 Дж/(моль∙К); 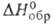 −143,2 кДж/моль; S0298 172,32 Дж/(моль∙К). ионный радиус и поляризуемость OH ~ в твердых гидроксидах велики, поэтому гидроксиды имеют рыхлую слоистую кристаллич. структуру с большой долей ковалентной составляющей связи металл—ОН. При гидролизе солей многовалентных металлов образуются не растворимые в воде полиядерные гидроксокомплексы, в которых имеются мостиковые связи, осуществляемые с помощью OH−.
−143,2 кДж/моль; S0298 172,32 Дж/(моль∙К). ионный радиус и поляризуемость OH ~ в твердых гидроксидах велики, поэтому гидроксиды имеют рыхлую слоистую кристаллич. структуру с большой долей ковалентной составляющей связи металл—ОН. При гидролизе солей многовалентных металлов образуются не растворимые в воде полиядерные гидроксокомплексы, в которых имеются мостиковые связи, осуществляемые с помощью OH−.
Для OH− в бесконечно разб. водном растворе: относительные парциальные моляльные теплоемкость и энтропия равны соотв. −139,7 и −10,5 Дж/(моль∙К); 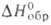 −230,0 кДж/моль; абс. подвижность 17,8∙10−8 м2/(с∙В). Присутствие в водном растворе OH− в концентрациях выше 10−7 моль/л приводит к щелочной реакции раствора. Ион OH−играет большую роль в хим. и биол. процессах в водных средах.
−230,0 кДж/моль; абс. подвижность 17,8∙10−8 м2/(с∙В). Присутствие в водном растворе OH− в концентрациях выше 10−7 моль/л приводит к щелочной реакции раствора. Ион OH−играет большую роль в хим. и биол. процессах в водных средах.
П. М. Чукуров
