гидроксиламин
ГИДРОКСИЛАМИН NH2OH
мол. м. 33,0298; бесцветные кристаллы. Конфигурация молекулы:
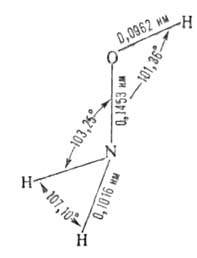
Кристаллич. решетка ромбическая; т. пл. 32 °C; плотн. 1,335 г/см3 (10 °C); 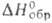 −115,1 кДж/моль,
−115,1 кДж/моль, 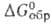 −17,4 кДж/моль,
−17,4 кДж/моль, 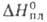 16,5 кДж/моль,
16,5 кДж/моль, 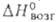 64,2 кДж/моль; для газа: С°p 46,67 Дж/(моль∙К); S0298 236,07 Дж/(моль∙К); давление пара при 32 °C 705 Па (в парах мономерен);
64,2 кДж/моль; для газа: С°p 46,67 Дж/(моль∙К); S0298 236,07 Дж/(моль∙К); давление пара при 32 °C 705 Па (в парах мономерен); 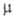 1,97∙10−30 Кл∙м.
1,97∙10−30 Кл∙м.
Г. очень гигроскопичен и термически нестабилен: медленно распадается выше температуры плавления, при быстром нагревании до 100 °C иногда происходит взрыв; осн. продукты распада-NH3, N2 и H2O. Расплав Г. легко переохлаждается и хорошо растворяет многие вещества, напр. NH3, KI, KCN, NaNO3, NaCl, NaOH. Г. смешивается с водой, этанолом и метанолом в любых соотношениях, но не раств. в эфире и бензоле. В водном растворе диссоциирует по кислотному (pKа 14,02) и основному (pKа 5,97) типу:
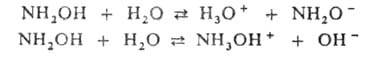
В кислом водном растворе Г. устойчив; однако ионы переходных металлов катализируют его распад, поэтому к раствору добавляют связывающие их вещества, напр. комплексоны, SnO2*xH2O или станнаты.
В водном растворе, как и в своб. состоянии, Г. может реагировать и как окислитель, и как восстановитель. Он восстанавливает, напр., Fe(III) до Fe(II), Cu(И) до Cu(I), Pu(IV) до Pu(Ш). Сильные восстановители (HI, H2S, SnCl2, цинковая пыль и др.) восстанавливают его до NH3. Кислород воздуха медленно окисляет Г. в щелочном (pH 12–13) растворе с образованием NO2− и H2O2. Жидкий Г. с активными окислителями (KMnO4, K2Cr2O7, BaO2, Cl2 и др.) реагирует с воспламенением, более спокойно — с Br2, K2CrO4, хлоратами, AgNO3 и др. С HNO2 в водном растворе Г. при комнатной температуре дает N2O и H2O. Реакция с разб. HNO, автокаталитическая с промежут. образованием HNO2. С газообразным NO в щелочном растворе Г. реагирует по уравнению: 2NH2OH + 2NO → N2O + N, + ЗH2O
Хотя кислотная функция у Г. выражена слабо, известно неск. его малостабильных солей, напр. NaH2NO, Ca(H2NO)2, и ряд более устойчивых комплексных соед., напр. [UO2(H2NO)2]*3H2O. Благодаря наличию неподеленных электронных пар на атомах азота и кислорода Г. легко образует прочные комплексы, напр. [Pt(NH2OH)4]Cl2, [Ni(NH2OH)n]Cl2, в которых молекула Г. связана с атомом металла через атом азота. Связь через атом кислорода осуществляется в кристаллич. комплексах [LiNH2OH)3]ClO4 (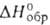 −799,1 кДж/моль), [Mg(NH2OH)6](C1O4)2 (
−799,1 кДж/моль), [Mg(NH2OH)6](C1O4)2 (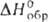 −1457,7 кДж/моль), [Ca(NH2OH)3](ClO4), (
−1457,7 кДж/моль), [Ca(NH2OH)3](ClO4), (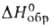 −1156,4 кДж/моль) и др. Они устойчивы до 100 °C и менее гигроскопичны, чем соответствующие простые соли М (ClO4)n и свободный Г. Реализуемая в этих комплексах изомерная структура ONH3 на 126 кДж/моль энергетически менее выгодна, чем структура Г. в своб. состоянии.
−1156,4 кДж/моль) и др. Они устойчивы до 100 °C и менее гигроскопичны, чем соответствующие простые соли М (ClO4)n и свободный Г. Реализуемая в этих комплексах изомерная структура ONH3 на 126 кДж/моль энергетически менее выгодна, чем структура Г. в своб. состоянии.
С сильными кислотами Г. образует соли, содержащие катион гидроксиламмония NH3OH. Наиб. важны хлорид NH3OHCl (т. пл. 1524:, плотн. 1,67 г/см3), сульфат (NH3OH)2SO4 (т. пл. 172 °C) и перхлорат NH3OHClO4 (т. пл. 89 °C, плотн. 2,07 г/см3, 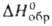 −281,6 кДж/моль). Все три соли — бесцветные кристаллы с моноклинной решеткой; хорошо раств. в воде, хлорид и перхлорат-также в спиртах и ацетоне. Хлорид и сульфат начинают медленно разлагаться ниже температур плавления, перхлорат — выше 100 °C.
−281,6 кДж/моль). Все три соли — бесцветные кристаллы с моноклинной решеткой; хорошо раств. в воде, хлорид и перхлорат-также в спиртах и ацетоне. Хлорид и сульфат начинают медленно разлагаться ниже температур плавления, перхлорат — выше 100 °C.
Атомы водорода в молекуле Г. могут быть замещены на разл. неорг. и орг. остатки. При замещении на группу SO3K образуются гидроксиламинсульфонаты — HONHSO3K, (KSO3)2NOH и KO3SON(SO3K)2. К этой группе производных Г. относятся гидроксиламин-О-сульфокислота H2NOSO3H, метилсульфонилгидроксиламин CH3SO2N(H)OH и N-амидосульфонилгидроксиламин H2NSO2N (Н)ОН, которые м. б. использованы для получения N2O. При нитрозировании Г. по атому N образуются азотноватистая кислота H2N2O2 и ее соли — гипонитриты, а при нитровании-соли азотноватой кислоты H2N2O3 (гипонитраты). С альдегидами и кетонами Г. и его соли дают соотв. альдоксимы и кетоксимы.
• см. также гидроксиламина производные органические
В лаборатории Г. можно синтезировать разложением в вакууме его солей, напр. (NH3OH)3PO4 или [Mg(NH2OH)6]ClO4. Спиртовый раствор Г. получают действием C2H5ONa на NH3OHCl. В промышленности соли Г. получают восстановлением NO водородом в присутствии Pt, нанесенной на графит, в среде разб, H2SO4 при 40 °C или гидрированием HNO3 в присутствии Pd в разб. H3PO4.
Г. и его соли применяют для получения оксимов (напр., циклогексаноноксима), гидроксамовых кислот. Г. — реагент для титриметрич. определения карбонильных соединений. Сульфат Г. — компонент проявителя цветной фото- и кинопленки. Перхлорат Г. — окислитель твердых ракетных топлив. Г. и его соли токсичны; при попадании на кожу вызывают экземы и нагноения, при попадании в кровь переводят гемоглобин в метгемоглобин и действуют на нервные центры. Для NH3OHCl ПДК в воде водоемов 5 мг/л.
Лит.: Брикун И.К., Козловский М.Т., Никитина Л,В., Гидразин и гидроксиламин и их применение в аналитической химии, А.-Д., 1967; Харитонов Ю. Я., Сару ханов М. А., Химия комплексов металлов с гидроксиламином, М., 1977.
В. Я. Росоловскип
Значения в других словарях
- Гидроксиламин — H2NOH, продукт замещения группой OH одного атома водорода в молекуле аммиака NH3: бесцветные кристаллы игольчатой формы. Плотность 1204,4 кг/м3 (при 23,5°С), tпл 33—34 °С, tkип 58 °С при 2,933 кн/м2 (22 мм pm. ст.). При 0°С... Большая советская энциклопедия
- Гидроксиламин — Биологически активное вещество, представляющее собой продукт замещения одного атома водорода в молекуле аммиака на гидроксил; является метгемоглобинообразователем; может вызывать аллергические дерматозы; Г. и его производные применяются в медицине как лекарственные средства. Медицинская энциклопедия
- ГИДРОКСИЛАМИН — ГИДРОКСИЛАМИН — NH2OH, бесцветные кристаллы; tпл 32 °С. Неограниченно растворим в воде. Ядовит. Взаимодействуя с кислотами, образует соли, напр. (NH3OH)2SO4. Применяют в производстве капролактама, в аналитической химии. Большой энциклопедический словарь
- Гидроксиламин — (хим.). Судя по названию (см. Гидроксил), это вещество есть продукт замещения водорода аммиака гидроксилом, NH2(OH) = NH3.O. Действительно, Г. обладает основными свойствами подобно настоящим аминам или алкалоидным аммиачным производным, напр. Энциклопедический словарь Брокгауза и Ефрона
