дисульфиды органические
ДИСУЛЬФИДЫ ОРГАНИЧЕСКИЕ (диорганилдисульфиды)
содержат в молекуле два связанных друг с другом атома серы. Орг. дисульфиды (Д.) можно рассматривать как производные дисульфана H2S2. Различают ациклич. (формула I), моноциклич. (II) и полициклич. Д. (напр., III).
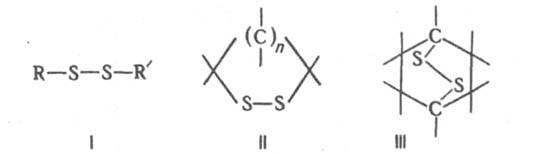
Алифатич. Д. типа I наз. также дитиаалканами, типа II — 1,2-дитиациклоалканами, III — эпидитиациклоалканами. Наиб. практич. значение имеют Д. типа I. Алифатич. соед. этой группы — высококипящие дурнопахнущие маслянистые жидкости, сильно преломляющие свет; ароматич. соед. — кристаллы. Длина связи S—S ок. 0,2 нм, барьер вращения вокруг этой связи до 67 кДж/моль, угол CSS ок. 103°, двугранный (диэдральный) угол CS—SC 80–100°. Энергия диссоциации дисульфидной связи ок. 293 кДж/моль, максимум поглощения — в области длин волн 245–325 нм, частота валентных колебаний — в интервале 500–800 см−1. Д. типа I не раств. в воде, хорошо раств. в органических растворителях. Хим. свойства Д. определяются низкой прочностью дисульфидной связи. Мн. восстановители, напр. NaHSO3, гидриды металлов, атомарный Н, легко восстанавливают Д. до тиолов. Восстановит. расщепление связи S—S вызывают также горячая вода под давлением, OH− (особенно легко — в присутствии солей тяжелых металлов) и CN− , монотиофосфорная кислота, третичные фосфины, некоторые тиолы, тио- и дитиогликоли. В кислых средах Д. восстанавливаются на ртутном катоде при потенциале до −2 В. Триалкилфосфиты десульфируют Д. до моносульфидов. Д. окисляются пероксидами или пероксокислотами до сульфокислот RSO3H, сульфиновых кислот RSO2H, тиосульфинатов RS(O)SR', тиосульфатов RSO2SR', α-дисульфонов RSO2SO2R'. При УФ облучении Д. образуют тиильные радикалы RS*. Д. легко взаимод. с Cl2, Br2 и сульфурилгалогенидами по схеме:
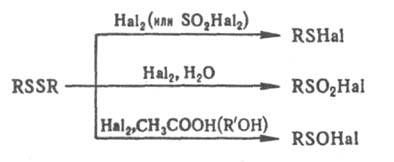
R — алкил, арил, алкенил, алкинил, аралкил, гетерил; R' — алкил. Д. получают: окислением тиолов, напр. O2, I2, H2O2; реакцией алкилгалогенидов или солей диазония с Na2S2; щелочным гидролизом (в присут. O2 или I2) солей изотиурония RSC(=NH)NH2.HHal, ксантогенатов ROC(S)SNa и солей Бунте RSSO3M; взаимод. диалкил- и диарилсульфидов с серой и др. способами. Ряд ароматич. Д. типа I получают сплавлением анилина или его производных с серой, из S2Cl2 и ароматич. соед. по реакции Фриделя — Крафтса. Для анализа Д. их предварительно восстанавливают до тиолов; для качеств. обнаружения используют реакцию тиолов с нитропруссидом Na. Определяют Д. амперометрич. титрованием растворами AgNO3, HgCl2 или ртутьорг. соединений. Наиб. чувствительный метод — флуорометрический при помощи меркуриацетата флуоресцеина. Д. используют для получения пестицидов, мед. препаратов, красителей, в орг. синтезе. Дисульфидные связи содержатся в молекулах мн. белков, некоторых прир. низкомолекулярных биологически активных соед. (напр., в цистине, липоевой кислоте). К прир. Д. типа III относятся спородесмины и некоторые антибиотики. Д. средне- или малотоксичны для теплокровных. В ряду Д. типа I токсичность снижается с увеличением мол. массы.
• см. диметилдисульфид, дитианы, дитиоланы, тетурам
Лит.: Оаэ Сигэру, Химия органических соединения серы, пер. с япон., М., 1975; Торчинский Ю. М., Сера в белках, М., 1977; Общая органическая химия, пер. с англ., т. 5, М., 1983, с. 445–59.
А. Ф. Коломиец, Н. Д. Чкаников
