кинетические методы анализа
КИНЕТИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
основаны на зависимости скорости хим. реакций от концентраций реагирующих веществ. Определять можно один из реагентов (некаталитич. методы) или катализатор и взаимодействующие с ним вещества (каталитич. методы, или каталиметрия). Реакция, с помощью которой определяют вещество, наз. индикаторной. Ее скорость находят по изменению во времени концентрации т. наз. индикаторного вещества, которым м. б. продукт реакции или исходное соединение. Для определения концентрации индикаторного вещества можно применять практически любые методы. Наиб. часто используют фотометрию, полярографию и потенциометрию. Реже скорость индикаторной реакции устанавливают по величине физ. параметра, напр. ΔH при экзотермич. процессах или интенсивности хемилюминесценции. Во всех случаях необходимо учитывать влияние на скорость реакции температуры, природы растворителя и ионного состава анализируемой смеси. Скорость индикаторной реакции А + В = Х + У в простейшем случае выражается кинетич. уравнением dx/dt=kab, где k константа скорости реакции, х, а и b концентрации соотв. индикаторного вещества X и реагентов А и В. Концентрация Сi определяемого вещества во время опыта не должна заметно изменяться. Это условие всегда соблюдается в каталитич. методах; в остальных случаях необходимо предварительно по зависимостям Ci — t выбирать подходящий интервал времени для наблюдения за скоростью процесса. В случае гомог каталитич. реакций, используемых обычно для определения концентрации катализатора Ск, кинетич. уравнение имеет вид: dx/dt=(ПCCк, где ( — константа скорости реакции (каталитич. коэф.), ПC — функция концентраций исходных веществ (обычно измеряют начальную скорость процесса, когда ПC практически постоянна). Если за время наблюдения концентрации веществ А и В существенно изменяются и по ним определяют скорость реакции, пользуются тггегральной формой кинетич. уравнений (причем один из реагентов, напр. В, берут в избытке по отношению к другому): lnа-ln(а-х)=kbt и lnа-ln(а — х)=(П'CCк, где П'C — функция концентрации вещества В. Концентрацию определяемого вещества рассчитывают по кинетич. уравнению или находят по градуиросочным графикам. В качестве последних используют зависимости между концентрацией определяемого вещества и скоростью реакции, обычно выражаемой отношением Δx/Δt (метод тангенсов), временем достижения определенной концентрации индикаторного вещества (метод фиксир. концентрации) или концентрацией индикаторного вещества в определенный момент времени (метод фиксир. времени). Каталитич. и некаталитич. методы имеют разные метрологич. характеристики. Чувствительность некаталитич. методов определяется чувствительностью метода, выбранного для контроля за скоростью реакции. Некаталитич. К. м. а. высоко селективны и позволяют определять без разделения близкие по свойствам вещества (РЗЭ, щел.-зем. металлы, орг. соед. одного гомологич. ряда, изомеры и др.). Каталитич. методы очень чувствительны, но, как правило, не отличаются высокой селективностью. Они широко применяются для определения следовых количеств веществ. Предел обнаружения катализатора
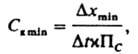
т. е. определяется чувствительностью метода измерения концентрации Δxmin, продолжительностью наблюдения Δt и активностью катализатора (т. е. величиной (). Теоретич. предел обнаружения 10−17 г/см3, практически достигается 10−9 10−10, а в ряде случаев 10−12 г/см3; относит, стандартное отклонение 0,1–0,3. Селективность каталитич. методов можно повысить, используя соответствующие активаторы, проводя индикаторные реакции в водно-орг. средах, вводя ингибиторы, маскирующие многие каталитически активные примеси. Часто проводят предварительное экстракц. или хроматографич. разделение исследуемой смеси, что позволяет существенно повысить избирательность каталитич. методов. В т. наз. экстракционно-каталитич. методах катализатор определяют непосредственно в экстракте. При этом можно добиться того, что катализировать индикаторную реакцию будет только одно определяемое вещество. Каталитич. К. м. а. применяют для определения не только катализаторов (напр., ионов переходных металлов), но и ингибиторов или активаторов (в частности, орг. соединений разл. классов) индикаторных реакций. Предложено св. 200 каталитич. индикаторных реакций. Чаще других используют гомог. окисление орг. и неорг. соединений кислородом. H2O2, такими кислородсодержащими ионами, как S2O8−2, ClO−3, BrO−3, IO−3, IO−4, MoO24, a также катионами переходных металлов, напр. Ce(IV), Fe(III). В качестве индикаторных используются также ферментативные реакции, позволяющие в значит. степени повысить чувствительность и, что особенно важно, селективность К. м. а. (см. ферментативный катализ). На взаимод. катализатора с ингибитором основаны методы каталиметрич. титрования, отличающиеся высокой воспроизводимостью (относит стандартное отклонение 0,01 0,03). В этих методах реакц. смесь с катализатором титруют раствором ингибитора, а точку эквивалентности устанавливают по резкому изменению скорости индикаторной реакции. Например, окисление аскорбиновой кислоты кислородом катализируют ионы Cu2+, которые определяют титрованием раствором CN, ЭДТА или др. ингибиторов, связывающих Cu2+ в каталитически неактивный комплекс. Этими методами можно определять ионы металлов с гораздо более высокой чувствительностью, чем, напр., комплексонометрически. К. м. а. широко применяют при анализе воды, воздуха, геол. объектов, в к линия, анализах, при биохим. исследованиях и т. д.
Лит.: Яцимирский К. Б., Кинетические методы анализа, 2 изд., М., 1967; Марк Г., Рехяиц Г., Кинетика в аналитической химии, пер. с англ., М., 1972; Мюллер Г. Отто М., Вернер Г., Каталитические методы в анализе следов элементов, пер. с нем., М., 1983; Крейнгольд С. У., Каталиметрия в анализе реактивов и веществ особой чистоты, М., 1983; Guilbault G.G., в кн.. International review of science. Physical chemistry, serie 1, v. 12, L Baltimore, 1973, p. 161 91; Yatsimirski К. В., там же, р. 193 215.
К.Б. Яцимирский
Значения в других словарях
- Кинетические методы анализа — Методы качественного и количественного химического анализа, основанные на зависимости между скоростью реакции и концентрацией реагирующих веществ. К. м. Большая советская энциклопедия
- КИНЕТИЧЕСКИЕ МЕТОДЫ АНАЛИЗА — КИНЕТИЧЕСКИЕ МЕТОДЫ АНАЛИЗА — методы качественного и количественного химического анализа, основанные на зависимости скорости реакций от концентраций реагирующих веществ. Используются для определения примесей в полупроводниковых материалах, микроэлементов в биологических объектах и т. п. Большой энциклопедический словарь
