кислотно-основной катализ
КИСЛОТНО-ОСНОВНОЙ КАТАЛИЗ (кислотно-основный катализ)
ускорение хим. реакций в присутствии кислот и оснований. В качестве катализаторов используют: в гомог. кислотном катализе протонные кислоты (H2SO4, HCl, H3PO4, CH3C6H4SO2OH и др.) в воде и водно-органических растворителях, апротонные кислоты (AlCl3, BF3, SnCl4 и др.) в неводных растворителях, сверхкислоты (HF SbF5, HSO3F SbF5 и др.) в неводных растворителях; в гетерог. кислотном катализе прир. глины, аморфные и кристаллич. алюмосиликаты, фосфорную и полифосфорные кислоты, нанесенные на носитель, катиониты; в гомог. основном катализе оксиды щелочных металлов, амины в воде, орг. и водно-органических растворителях; в гетерог основном катализе — оксиды металлов (CaO, MgO и др.). При К.-о. к. в большинстве случаев из реагентов и катализатора в равновесных стадиях образуются реакционноспособные (а также нереакционноспособные) комплексы разл. состава, которые являются ионизир. формой реагента. В лимитирующих стадиях комплексы превращ. в продукты реакции. В случае реакции с одним реагентом (Р) эти стадии выражаются уравнением:
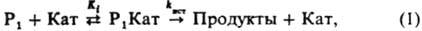
где Кат-разл. формы катализатора: недиссоциир. кислоты или основания, ионы или ионные пары, образующиеся при их ионизации; P1 Кат-комплексы; Ki — константа равновесия образования комплексов Р1 Кат; kист — элементарная константа скорости превращ. комплексов в продукты. В случае реакции двух реагентов (P1+P2: Продукты; P2+P2: Продукты) реакционноспособный комплекс образуется, как правило, из комплекса одного реагента с несвязанным в комплекс др. реагентом:
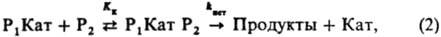
где Kк — константа равновесия образования комплексов Р1 Kат P2. Константы равновесия Ki и Kк выражают уравнениями:
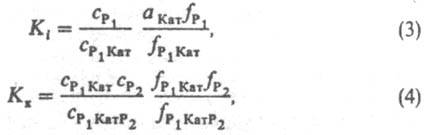
где (здесь и далее) а, с, f — соотв. термодинамич. активность, концентрация и коэф. активности реагирующих частиц; aKатfP1/fP1Кат — функция, характеризующая способность среды переводить реагенты в комплексы РКат. При варьировании в широких пределах сКат реализуются (особенно в растворах) неск. маршрутов реакции — хим. превращений, приводящих к образованию одних и тех же продуктов через реакционноспособные комплексы (РК) разл. состава. В растворе с постоянной сКат скорость реакции по каждому маршруту Wi выражается уравнением:
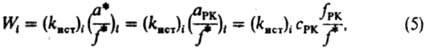
где (kист)i — элементарная константа скорости по i-му маршруту, а* и f* — относятся к активир. комплексу. Из опытных данных следует, что множитель fРК/f* не изменяется при варьировании сКат и его приравнивают к единице. В растворе с постоянной сКат наблюдаемая скорость реакции
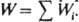
Экспериментально определяют эффективную константу скорости kэфф, характеризующую скорость реакции при постоянной температуре и наличии катализатора определенного состава. В уравнениях для связи fэфф со свойствами катализатора учитывают все его комплексы с реагентом: реакционноспособные (РКат)РК и нереакционноспособные (РКат)НРК. Например, при кислотном гидролизе амидов, анилидов ионизированная по атому азота форма является реакционноспособной, ионизированная по карбонильной группе — либо намного менее реакционноспособна, либо нереакционноспособна. Для описания влияния ионизирующих свойств среды на kэфф совместно решают уравнение материального баланса для текущих концентраций реагентов и уравнения (3) и (5) в случае реакции одного реагента и дополнительно уравнение (4) для реакции двух реагентов. напр. для реакции, протекающей по схеме (2):

В случае реакции двух реагентов, если один (P2) является компонентом растворителя (напр., H2O при гидролизе в водных растворах), при условии ср2>ер1 вычисляют эффективную константу скорости первого порядка, включающую термодинамич. активность растворителя. В реакциях Рх с P2 в растворах кислот и оснований реакционноспособный комплекс состава P1KaтP2 может получаться и в лимитирующей стадии из ионизир. формы одного реагента и неионизир. формы другого:
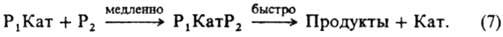
В этом случае для описания влияния ионизирующих свойств среды на kэфф пригодно уравнение (6), при замене величины (fP2сP2)/(KкfP1КатP2) на термодинамич. активность растворителя. Поскольку крайне редко удается установить прямыми физ. методами состав и концентрацию промежут. комплексов, в настоящее время основным методом установления их состава, детального механизма реакции и вычисления величин Ki и Kк является кинетич. метод, основанный на применении уравнений типа (6) для объяснения наблюдаемой зависимости kэфф от ионизирующей способности среды. Для этого измеряют kэфф в широком диапазоне сКат в растворе и подбирают функции аКат fP/fPКат для описания влияния среды на kэфф. Наиб. исследованы каталитич. свойства сильных кислот в водных растворах. Ионизирующая способность таких растворов обусловлена образованием комплексов реагента: 1) с сольватированным протоном и 2) с недиссоциированной кислотой. К первым относятся протонир. форма реагента и ее комплексы с растворителем. В этом случае аКатfP/fPKат выражают (для водных растворов) функциями h0 =aH3O+fP/fPH+, h0aH2O и h0a2Н2O, где h0 — измеренная индикаторным методом кислотность среды, fРН+ — коэф. активности протонир. формы реагента. Ко вторым относятся комплексы реагента с кислотой (НА) и ее гидратами. При этом aКатfР/fРКат кат принимает значения аНА, aНАaН2O и др. При гидролизе некоторых карбонильных соед. aКатfP/fРКат=cH5O2+ Однозначную информацию о составе реакционноспособных комплексов, как правило, получают на основании данных по изменению kэфф в растворителе постоянного состава при варьировании сКат в широких пределах в условиях малой степени связывания реагента в комплексы. Наиб. простые зависимости получают для реакции одного реагента, когда он равновесно связывается только в один реакционноспособный комплекс. В таком случае уравнение (4) упрощается:
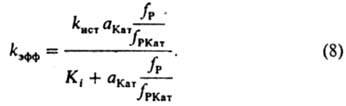
Опытным путем установлено, что в водных растворах сильных кислот kист не зависит от сКат. Ki, по определению, не должно зависеть от сКат. Вопрос о влиянии состава смешанного растворителя на kист пока достаточно не исследован. В условиях, когда Ki и (aКатfР)/fРКат соизмеримы, по уравнению (8) вычисляют раздельно kист и Ki. При аКатfР/fРКат > Ki величина kэфф=kист; при kКатfP/fРКат<i имеет место соотношение:
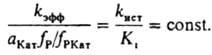
Ниже приведен пример, раскрывающий природу каталитич. действия водных растворов кислот в условиях, когда реакционноспособный комплекс образуется и превращ. в продукты согласно схеме (1) при условии, что аКатfP/fРКат<i. Ионизирующая способность среды из-за превращ. реагента в протонир. форму и ее комплексы с H2O проявляется при наличии зависимостей Kэфф/h0=const, kэфф(h0aH2О)=const kэфф/(h0a2H2O)=const. Если в реакции kэфф/h0=const (lgkэфф+H0=const, где H0=-lgh0 — функция кислотности Гаммета), то aкатfP/fКат=h0 и реакционноспособным комплексом является протонир. форма реагента PH3O+. Такая закономерность имеет место при проведении пинаколиновой перегруппировки в конц. H2SO4:
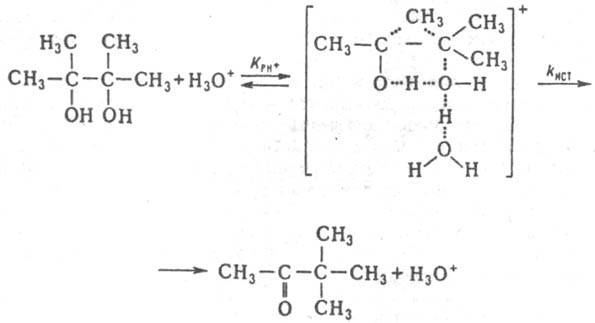
При варьировании сKaт значение kэфф/(h0аH2O) постоянно в реакциях дегидратации, напр. 2-фенил-2-пропанола в серной кислоте, 2-метил-2-бутанола в азотной кислоте. Следовательно, аKатfP/fPKaт равно h0аH2O и реакционноспособным является комплекс молекулы воды с протонир. формой реагента. Имеется и пример постоянства kэфф/(h0a2H2O), что наблюдается в реакции изотопного обмена атома кислорода в CH3OH, протекающего в серной и хлорной кислотах. В этом случае аKaт/fP/fРКaт=h0a2H2O и реакционноспособным является симметричный комплекс:
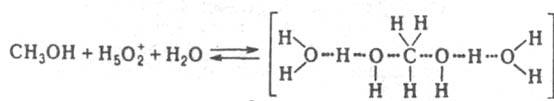
Функции h0, h0аH2O и h0а2H2O стандартизованы к воде, и в сильно разбавленных растворах сильных кислот они численно равны концентрации ионов H5О+2 в моль/л. В таких растворах для приведенных выше реакций при варьировании сKaт должно соблюдаться постоянство значений kэфф/cH2O+. При гидролизе некоторых амидов, анилидов, сложных эфиров kэфф/cH2O+ постоянно не только в разбавленных, но и в конц. водный растворах HClO4, H2SO4. Если гидролиз протекает по схеме (1), то реакционноспособный комплекс образуется из реагента и иона H5O2+, а выраженная в концентрациях константа равновесия KH5O2+; не изменяется при варьировании сКат:
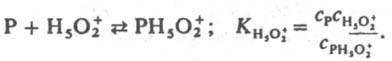
Не исключено, что kэфф/cH2O+=const из-за того, что реакция протекает по схеме (7) Ионизирующая способность среды из-за комплексообразования реагента с молекулами недиссоциир. сильной кислоты и ее гидратом проявляется при наличии зависимостей kэфф/aHA=const, kэфф/(aHAaH2O)=const и др. В первом случае aKaт=const и реакци онноспособный комплекс имеет состав РИА; такая закономерность, напр., реализуется при дегидратации β-фенил-β-гидроксипропионовой кислоты и 2-(4-мето-ксифенил)-2-пропанола в серной кислоте. Во втором случае акатfP/fPKат=аHАаH2O и комплекс имеет состав РНАH2O. Гидрат НА.H2O можно рассматривать и как ионную пару H3O+А−. Каталитич. активность гидратов сильных кислот проявляется в реакциях дегидратации 1-фенилэтанола в хлорной кислоте, гидратации цис-коричной кислоты и рацемизации β-фенил-β-гидроксипропионовой кислоты в серной кислоте. Согласно уравнению (6), должен наблюдаться максимум kэфф в зависимости от сКат, если наряду с реакционноспособными образуются и нереакционноспособные комплексы и при увеличении сКат значение aКат/fP/fPKат для нeрeакционноспособных комплексов возрастает быстрее и более резко, чем для реакционноспособных. Например, если aКатfP/fPKaт равно сH5O2+ для реакционноспособных комплексов и равно h0, либо h0aH2O для нереакционноспособных. В водных растворах слабых кислот каталитич. активность проявляют ионы и недиссоциир. молекулы кислоты. Взаимосвязь между каталитич. активностью слабых кислот и их константами диссоциации в некоторых случаях удается описать корреляц. уравнением Брёнстеда . В сильно разбавленных водных растворах оснований ндблюдается постоянство kэфф/cOH — при варьировании сOH-. Обоснованных количеств. характеристик ионизирующей способности умеренно конц. и конц. растворов оснований пока нет. Добавление солей к водным растворам кислот и оснований существенно изменяет их каталитич. активность; в случае слабых кислот и оснований изменяется степень их диссоциации на ионы из-за наличия общего иона и увеличения ионной силы раствора. В случае сильных кислот изменяются величины h0, аНА, аН2O, что приводит к увеличению относит, концентрации комплексов, образующихся из частиц H3O+ А−, НА, а также усилению реакц. способности ионов H5O2+, напр. при гидролизе в условиях, когда aКатfP/fPKат=сH2O+. В случае сильных оснований катионы металлов усиливают каталитич. действие сольватир. ионов OH−. Лимитирующие стадии катализируемых кислотами и основаниями реакций часто осуществляются по синхронным механизмам. В неводных растворителях кислоты и основания образуют преим. мол. комплексы. Каталитич. действие апротонных кислот обусловлено образованием из них и реагентов мол. реакционно-способных комплексов. Катиониты в Н-форме и нанесенные кислотные катализаторы обладают каталитич. активностью гл. обр. из-за наличия жидкой фазы, содержащей кислоту. Нанесенные кислотные катализаторы готовят нанесением на носитель (силикофосфат SiO2.P2O5, силикагель, кварц, фосфаты) разл. жидких кислот, гл. обр. фосфорной. Каталитич. активность таких катализаторов зависит от количества нанесенной кислоты на 1 г носителя и ее концентрации в жидкой фазе, зависящей от равновесного давления водяного пара над катализатором. Для характеристики ионизирующих свойств нанесенных кислотных катализаторов можно использовать такие же функции аКaтfP/fPKaт, как и для растворов. Специфич. свойство практически всех гетерог. кислотно-основных катализаторов наличие на их поверхности центров разл. силы (кислотной или основной), что обусловлено неоднородностью поверхности твердых тел. Из-за наличия подобных центров образуются сильно поляризованные комплексы реагента с катализатором. Энергетически выгодными являются синхронно протекающие лимитирующие стадии. Так, крекинг парафинов на Al2O3 может протекать по схеме:
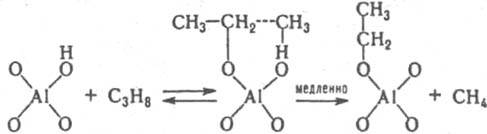
Лит.: Гаммет Л , Основы физической органической химии, пер. с англ., М., 1972; Танабе К. Твердые кислоты и основания, пер. с англ., М., 1973, Белл Р , Протон в химии, пер. с англ., М., 1977; Виниик М И , "Кинетика и катализ", 1980. т 21. в. I.e. 136 58. Казанский В Б. там же. 1987. т 28. в. I, с. 47 60
М. И. Винник
