кислоты неорганические
КИСЛОТЫ НЕОРГАНИЧЕСКИЕ
неорг. вещества, молекулы которых при электролитич. диссоциации в водной среде отщепляют протоны, в результате чего в растворе образуются гидроксоний-катионы H3O+ и анионы кислотных остатков А−:
НА+H2ODH3O++А (1)
Исключение составляет борная кислота В(OH)3, которая акцептирует ионы OH−, в результате чего в водном растворе создается избыток гидроксоний-катионов:
В(OH)3+2H2OD[В(OH)4]−+H3O+
Число отщепляемых от молекулы кислоты протонов наз. основностью кислоты. Теории кислот и оснований (Брёнстеда , Льюиса и др.) кроме указанных выше относят к кислотам мн. иные соед. (см. кислоты и основания). Общее свойство кислот — способность реагировать с основаниями и основными оксидами с образованием солей, напр.:
HNO3+NaOH:NaNO3+H2O 2HCl+CaO:CaCl2+H2O
К. н. подразделяют на кислородсодержащие (оксокислоты) общей формулы HnЭОm, где Э — кислотообразующий элемент, и бескислородные HnХ, где X — галоген, халькоген или неорг. бескислородный радикал (CN, NCS, N3 и др.). Оксокислоты характерны для мн. хим. элементов, особенно для элементов в высоких ( +3 и выше) степенях окисления. Атомы Н в оксокислотах обычно связаны с кислородом. Если в оксокислоте имеются атомы Н, не связанные с кислородом (напр., два атома Н, образующие связи Р—Н в H3PO2), то они не отщепляются в водном растворе с образованием H3O+ и не принимают участия в реакции кислот с основаниями. Некоторые кислоты известны в двух таутомерных формах, различающихся положением атома Н, напр.:
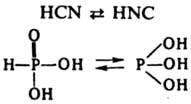
Молекулы мн. кислот содержат более одного атома кислотообразующего элемента Э. Очень многочисленны изополикислоты, содержащие атомы Э, связанные через атом кислорода, причем фрагменты —Э—О—Э— могут образовать как открытые цепи (напр., в H4P2O7), так и циклич. структуры [напр., в (HPO3)n]. В некоторых кислотах содержатся цепи из одинаковых атомов, напр., цепи —S—S— в политионовых кислотах H2SnО6 и сульфанах H2Sn. Известны гетерополикислоты (см. гетерополисоединения), имеющие фрагменты —Э—О—Э'—, где Э и Э' — атомы двух разных элементов, напр.: H4[SiW12O40].14H2O. Существует множество комплексных кислот, напр.: H2[SiF6], H[AuCl4], H4[Fe(CN)6]. Кислоты, аналогичные оксокислотам, но содержащие вместо атома (атомов) кислорода серу, наз. тиокислотами, напр. H2S2O3, H3AsS3. Пероксокислоты, напр. H2S2O8, имеют пероксогруппы —O—O— (см. пероксидные соединения неорганические). Константу равновесия реакции (1) называют константой кислотности Kа. Многоосновные кислоты диссоциируют ступенчато, каждой ступени отвечает своя Kа, причем всегда Ka(1)>Kа(2)...; ориентировочно каждая послед. Kа меньше предыдущей на 5 порядков. По значению pK1=-lgKa(1) К. н. подразделяют на очень слабые, слабые, средней силы, сильные, очень сильные (см. кислоты и основания). Согласно правилу Полинга, для очень слабых оксокислот HnЭОm разность m-n=0, для слабых, сильных и очень сильных эта разность составляет соотв. 1, 2 и 3. Данная закономерность обусловлена сдвигом электронной плотности от связи H—O к связям Э=О (содержащим атом О с большим значением электроотрицательности) и делокализацией электронной плотности в анионе. Для характеристики кислотности веществ в неводных средах используют функцию кислотности Гаммета H0 (см. корреляционные соотношения). Известны жидкости, для которых H0 более отрицательна, чем для конц. водных растворов очень сильных кислот, таких, как HNO3, H2SO4. Эти жидкости наз. сверхкислотами. Примеры: 100%-ная H2SO4 (H0=-12), безводная фторсульфоновая кислота HSO3F (H0=-15), смесь HF и SbF5 (H0=-17), 7%-ный раствор SbF5 в HSO3F (H0=-19,4). Эквимолярную смесь HSO3F и SbF5 называют "магической кислотой". Сверхкислотность обусловлена исключительной слабостью взаимод. с протоном соответствующих анионов (HSO−4, SbF−6 и др.). В среде сверхкислот протонируются вещества, обычно не проявляющие основных свойств, в частности углеводороды. Это явление используют на практике, преим. в орг. синтезе (алкилирование по Фриделю — Крафтсу, гидрирование нефти и др.). Мн. оксокислоты (HNO3, HMnO4, H2Cr2O7, HClO и др.) — сильные окислители. окислит. активность этих кислот в водном растворе выражена сильнее, чем у их солей. Все пероксокислоты — сильные окислители. К. н. всегда менее термически устойчивы, чем их соли, образованные активными металлами (Na, К и др.). Некоторые К. н. (H2CO3, H2SO3, HClO и др.) невозможно выделить в виде индивидуальных соед., эти К. н. существуют только в растворе. Общие методы получения К. н.: взаимод. оксидов (ангидридов) с водой, напр.:
P2O5+H2O:H3PO4
вытеснение более летучей К. н. из ее соли менее летучей К. н., напр.:
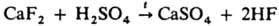
действие H2SO4 на раствор бариевой соли данной К. н., напр.:
Ва(H2PO2)2+H2SO4:BaSO4+2H3PO2
гидролиз галогенидов или солей, напр.:
Рl3+ЗH2O:H3PO3+3HI Al2Se3+6H2O:2Al(OH)3+3H2Se
замена катионов растворенных солей на Н с помощью катионита. Существует также множество др. методов получения К. н. К. н. применяют в промышленности и в научных исследованиях. В больших количествах производят серную кислоту, азотную кислоту, фосфорную кислоту, соляную кислоту и др.
Лит.: Некрасов Б. В., Основы обшей химии, 3 изд., т. 1–2, М., 1973; Кемпбел Дж., Современная общая химия, пер. с англ., т. 1–3, М., 1975; Белл Р., Протон в химии, пер. с англ., М., 1977; Хьюи Д., Неорганическая химия, пер. с англ., М., 1987.
С. И. Дракин
