метилдихлорфосфин
МЕТИЛДИХЛОРФОСФИН CH3PCl2
мол. м. 116,86; бесцв. дымящая на воздухе жидкость с резким неприятным запахом; т. пл. −60 °C, т. кип. 81–82 °C; 4° 1,3040; nD20 1,4960. Раств. в органических растворителях, гидролизуется водой. По х-им. свойствам-типичный представитель галогенфосфинов. При высокой температуре разлагается:
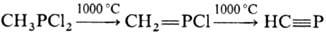
При действии избытка Cl2 образует трихлорметилтетра-хлорфосфоран CCl3PCl4.
В промышленности М. получают алкилированием белого или красного Р метилхлоридом в присутствии катализатора (обычно порошкообразная Cu или ее соли) при 300–350 °C, прямым фосфорилированием CH4 под действием PCl3 при 600 °C с послед. удалением избытка PCl3 обработкой реакц. смеси фенолом. В лаборатории М. синтезируют взаимод. PCl3, CH3Cl и AlCl3 (Клея-Киннера-Перрена реакция) с послед. восстановлением образовавшегося комплекса электрохимически, алюминием или цинком: PCl3 + CH3Cl + AlCl3 → [CH3PCl3] [Al2Cl7] → CH3PCl2. М. получают также восстановлением CH3Р(Х)Cl2 алюминием или Zn (X = О) или R3P (X = S), алкилированием PCl3 тетраметилсвинцом. М. применяют для получения эфиров, амидов метилфосфо-нистой кислоты и др. фосфорорг. соединений. М. токсичен, раздражает кожу и слизистые оболочки.
Лит.: Houben-Weyl, Methoden der organischen Chemie, 4 Aufl., Bd 12, Stuttg-N. Y., 1963; Bd E 1, E 2, N. Y., 1982; Kosolapoff G. M., Maier L., Organic phosphorus compounds, v. 4–5, N.Y., 1972.
Н. В. Лукашев
