натрия оксид
НАТРИЯ ОКСИД Na2O
бесцветные кристаллы кубич. сингонии (а = 0,556 нм, z = 4, пространственная группа Fm3m); при 750 °C эта модификация (a) переходит в кубич. модификацию b; при 970 °C b-Na2O превращ. в кубич. модификацию g. Т. пл. 1132 °C (в инертной атмосфере), плавление сопровождается сублимацией Н. о., который в газообразном состоянии частично диссоциирует на Na и O2; для a-Na2O: плотн. 2,37 г/см3, C0p 69,0 Дж/(моль∙К), ΔH0обр −414,8 кДж/моль, DG0обр −376,1 кДж/моль, ΔH0пл 36,0 кДж/моль, S0298 75,3 Дж/(моль∙К). Н.о. с водой образует NaOH, с серой -Na2S и Na2SO4, с CO2-Na2CO3, с аммиаком -NaNH2 и NaOH, с водородом — NaH и NaOH, с хлором-Na2O2 и NaCl. При нагр. на воздухе до 400 °C Н.о. превращ. в Na2O2.
Чистый Н. о. получить непосредств. окислением Na нельзя, т. к. одновременно образуется Na2O2, который восстанавливается до Na2O в присутствии избытка Na с большим трудом. Н.о. всегда содержится в виде примеси в Na2O2, образующемся при горении Na на воздухе. Для получения чистого Na2O используют след. реакции, протекающие при нагр.:
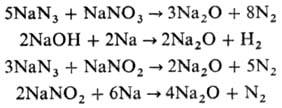
Хранить Na2O лучше всего в безводном бензоле.
Н. о. — реактив для разл. синтезов.
Б. Д. Степин
