пирогидролиз
ПИРОГИДРОЛИЗ (от греч. pyr — огонь и гидролиз)
высокотемпературное разложение неорг. веществ под действием водяного пара. П. подвергаются соли термически устойчивых в газовой фазе кислот (напр., бораты, галогениды, сульфиды), а также нитраты, комплексные соединения и др. Протекает с образованием оксидов или гидроксидов, напр.:
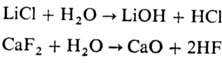
На промежут. стадиях образуются оксо- или гидроксосоли, иногда П. сопровождается изменением степени окисления металла, напр.:
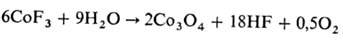
Неорг. вещества с преим. ковалентным характером связи, кроме SiF4 и некоторых др., подвергаются П. при температурах ненамного выше комнатной, ионные соед. — при температурах, достигающих 800–1200 °C. Для ускорения П. ионных веществ используют добавки SiO2, Al2O3, V2O5, U3O8 и др., получая в продуктах реакции соли, анионы которых образовались из добавок, как, напр., в случае окислительного П.:
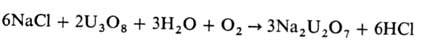
В промышленности с помощью П. проводят обесфторивание расплавл. фосфатов, превращ. UF6 в UO2F2 и далее в UO2 (здесь П. сочетается с восстановлением U6+ до U4+ водородом), а также получают тонкодисперсные, волокнистые или плавленые оксиды, заготовки для вытягивания кварцевых световодов, используя летучие хлориды (SiCl4, GeCl4, TiCl4), фториды (SiF4) или непосредственно водные растворы (H2SiF6). Разработаны процессы пирогидролитич. получения фтористоводородной кислоты из низкосортных флюоритовых руд и отходов алюминиевых и фосфорных производств.
Для проведения П. используют циклонные печи, а также пламенные реакторы, трубчатые вращающиеся печи, печи с барботированием водяного пара через расплав. В ряде случаев тепло и водяной пар подводят, сжигая H2, C3H8 или прир. газ в O2 или на воздухе непосредственно в зоне реакции. П. применяют в аналит. химии для определения содержания фтора и хлора. Платиновую лодочку с навеской вещества помещают в обогреваемую платиновую трубку, соединенную с источником водяного пара и конденсатором (или абсорбером) пара, напр. сосудом с раствором щелочи. По завершении П. концентрацию уловленного летучего продукта определяют титриметрически. Во мн. случаях П. позволяет по массе твердого остатка определить и содержание металла в пробе.
П. лежит в основе ряда протекающих в природе процессов, таких, как выделение B2O3 из фумарол, выделение HF и HCl из земных пород. Неконтролируемый П. при производстве керамики, стекла, металлов и др. вызывает загрязнение атмосферы HF, HCl, H2S и др. газами.
Лит.: Вольфкович СИ., Илларионов В. В., Малый А. А., Гидротермическая переработка фосфатов на удобрения и кормовые средства, M.-Л., 1964; Бок Р., Методы разложения в аналитической химии, пер. с англ., М., 1984; Раков Э. Г., Тесленко В. В., Пирогидролиз неорганических фторидов, М., 1987.
Э. Г. Раков
