полисульфиды органические
ПОЛИСУЛЬФИДЫ ОРГАНИЧЕСКИЕ (органилполисульфиды)
соед. общей формулы RSxR', где R и R'-алкил, арил, аралкил, циклоалкил, x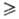 3. Алифатические П. о. — высококипящие жидкости, ароматические-кристаллич. вещества. Длины связей между атомами серы в П. о. 0,204–0,212 нм. Энергия диссоциации связи S—S уменьшается с ростом числа атомов серы и практически не отличается от энергии разрыва связи O—O в пероксидах (менее 146 кДж/моль); максимум поглощения П. о. — в области длин волн 241–316 нм, с увеличением числа атомов серы происходит смещение максимума поглощения в длинноволновую часть спектра; валентные колебания связи S—S проявляются в интервале 500–800 см−1.
3. Алифатические П. о. — высококипящие жидкости, ароматические-кристаллич. вещества. Длины связей между атомами серы в П. о. 0,204–0,212 нм. Энергия диссоциации связи S—S уменьшается с ростом числа атомов серы и практически не отличается от энергии разрыва связи O—O в пероксидах (менее 146 кДж/моль); максимум поглощения П. о. — в области длин волн 241–316 нм, с увеличением числа атомов серы происходит смещение максимума поглощения в длинноволновую часть спектра; валентные колебания связи S—S проявляются в интервале 500–800 см−1.
Хим. свойства П. о. определяются низкой прочностью связи S—S. Эта связь легко разрывается под действием электроф., нуклеоф. реагентов и своб. радикалов. При реакции П. о. с аминами происходит десульфуризация с образованием моносульфидов, при этом легкость расщепления связи S—S уменьшается с уменьшением основности амина. Взаимод. диалкил- и дибензилтетрасульфидов, а также трисульфидов с Ph3P приводит к дисульфидам, напр.:
RS4R + 2Ph3P → RSSR + 2Ph3PS
PhCH2SSSCH2Ph + Ph3P → PhCH2SSCH2Ph + Ph3PS Тетрасульфиды легко десульфуризуются сульфит-ионами, напр.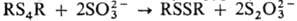 . Действие металлов (напр., Cu, Hg) на дитолил- и дибензилполисульфиды приводит к моносульфидам. При взаимодействии П. о. с S8 образуются разветвленные структуры со связями S=S.
. Действие металлов (напр., Cu, Hg) на дитолил- и дибензилполисульфиды приводит к моносульфидам. При взаимодействии П. о. с S8 образуются разветвленные структуры со связями S=S.
П. о. легко восстанавливаются LiAlH4 до тиолов, с реактивом Гриньяра образуют тиолы и сульфиды.
Окисление П. о. пероксидами и перкислотами приводит к сульфокислотам RSO2OH либо сульфиновым кислотам RSO2H; при действии тетраацетата свинца образуются сульфинаты RS (О) OR', при реакции тетрасульфидов с озоном — ангидриды сульфокислот RSO2OSO2R и SO2.
Взаимодействие П. о. с Cl2 или Br2 в водных растворах приводит к галогенангидридам сульфокислот RSO2Hal, при проведении реакции в неполярных растворителях образуются сульфенилгалогениды RSHal (реакция идет как электроф. замещение галогеном атома S).
Получают П. о. взаимод. алкилгалогенидов с полисульфидом Na, тиолов с хлоридами S, окислением гидродисульфидов, напр.:
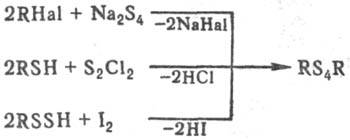
Используют также взаимод. элементарной S с олефинами. При нагр. дигалогеналканов, напр. 1,2-дихлорэтана с избытком Na2S4, обычно образуются полимерные полисульфиды (—CH2CH2SSSS—)n (см. полисульфидные каучуки).
Применяют П. о. для получения пестицидов, красителей, лек. препаратов (напр., трисульфид [NaO2S(CH2)4S]2S предложен для лечения лучевой болезни). П. о., способные к радикальному расщеплению, могут применяться как инициаторы радикальной полимеризации; П. о. используют в качестве вулканизаторов резин, сернистых красителей.
П. о. играют важную роль в живом организме; полисульфидные фрагменты входят в белковые молекулы.
Лит. см. при ст. дисульфиды органические.
А. В. Анисимов
