протонирование
ПРОТОНИРОВАНИЕ
процесс переноса протона с кислоты на прогофильную частицу (основание):
АН + В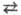 А− + ВH+ АН-кислота, В-основание
А− + ВH+ АН-кислота, В-основание
Доноры протонов в П. — кислоты Брёнстеда (см. кислоты и основания), в частности OH-, NH-, CH- и вообще ЭН-кислоты (см. CH-кислоты), акцепторы-разл. основания. Возможность протекания П. обусловлена относит. силой кислоты и основания. Например, для таких сильных оснований, как карбанионы или амидные анионы, донорами протонов могут служить весьма слабые CH-кислоты; сильные протонные кислоты и особенно сверхкислоты (см. кислоты неорганические) позволяют осуществить протонирование таких молекул, как карбоновые кислоты и даже насыщ. углеводороды, напр.:
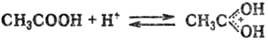
П. может происходить как межмолекулярно, так и внут-римолекулярно и сопровождаться перемещением кратной связи, образованием циклич. структуры, изменением валентности атома, к которому мигрирует протон, и др. превращениями.
П. протекает с очень высокой скоростью. Так, в водных растворах протонирование оснований типа анионов неорг. и орг. кислот, алкоксид-ионов, феноксид-ионов, аминов, циклич. N-oc-нований происходит обычно с константой скорости k ок. 1010 дм3/(моль∙с). Быстрее всего протонируется НО− [ок. 1,5∙1011 дм3/(моль∙с)], что обусловлено перемещением H+ по эстафетному механизму, по депочке водородных связей. В случае П. карбанионов k варьирует в очень широких пределах [~ от 1 до 1010 дм3/(моль∙с)] из-за необходимости перестройки электронной или геом. структуры протофиль-ной частицы при переносе протона. На скорость П. в неводных средах сильное влияние оказывают сольватация и ионная ассоциация.
Количеств. данные о кинетике и механизме П. получают с помощью спец. методов изучения быстрых реакций (см. струевые кинетические методы, релаксационные методы, электрохимическая кинетика). Информацию о тонких деталях механизма П. дают зависимости (соотношения Брён-стеда ) k от кислотности (рKа) или основности (рKb) участвующих в П. реагентов и величины кинетич. (первичного и вторичного) изотопных эффектов и изотопного эффекта растворителя. Предполагается, что в некоторых хим. процессах П. может происходить без преодоления энергетич. барьера (туннельный эффект).
Енолизация, изотопный водородный обмен, ионный обмен, гидролиз, гидратация, этерификация-явления, в которых П. — обязательная или возможная стадия.
Лит.: Шатенштейн А. И., Теории кислот и оснований, М.-Л., 1949; Меландер Л., Изотопные эффекты в скоростях реакций, пер. с англ., М., 1964; Белл Р., Протон в химии, пер. с англ., М., 1977; Гордон Дж., Органическая химия растворов электролитов, пер. с англ., М., 1979; Химия гиперкоординиро-ванного углерода, пер. с англ., М., 1990, с. 169–229, 253–327.
А. А. Соловьянов
