рений
РЕНИЙ (от лат. Rhenus — река Рейн; Rhenium) Re
хим. элемент VII гр. периодической системы, ат. н. 75, ат. м. 186,207. Природный Р. состоит из двух изотопов: стабильного 185Re (37,4%) и слаборадиоактивного 187Re (62,6%, T1/2 5∙Ю10 лет). Поперечное сечение захвата тепловых нейтронов для природного Р. 8,6∙10−27 м2.
Конфигурация внеш. электронных оболочек атома 5d56s2; энергии ионизации при последоват. переходе от Re0 к Re7+ соотв. 7,88, 16,6, 26,0, 37,7, 51, 64 и 79 эВ; электроотрицательность по Полингу 1,9; сродство к электрону 0,15 эВ; атомный радиус 0,1373 нм, ионные радиусы (в скобках указано координац. число) Re4+ 0,077 нм (6), Re5+ 0,072 нм (6), Re6+ 0,069 нм(6), Re7+ 0,052 (4) и 0,067 нм(6).
Р. — типичный рассеянный элемент. Его содержание в земной коре 7∙10−8% по массе. Самостоят. минералы Р. не найдены. Повыш. содержание Р. отмечено в колумбите, танталите, цирконе, минералах РЗЭ, сульфидах Cu и Mo (молибдените), а также горючих сланцах. Мировые запасы Р. (в пересчете на металл) ок. 10 тыс. т, в т. ч. в молибденито-вых концентратах более 3 тыс. т.
Свойства. Р. — серебристо-серый металл; кристаллич. решетка гексагональная, а = 0,2760 нм, с = 0,0458 нм, z = 2, пространственная группа P63/ттс; т. пл. 3180 °C (по тугоплавкости уступает лишь W); температура начала рекристаллизации 1550 °C; т. кип. 5600 °C; плотн. 21,01 г/см3; 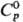 28,43 Дж/(моль∙К); ΔHпл 33,5 кДж/моль, ΔHвозг 783 кДж/моль (0 К);
28,43 Дж/(моль∙К); ΔHпл 33,5 кДж/моль, ΔHвозг 783 кДж/моль (0 К); 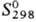 37,2 Дж/(моль∙К); уравнение температурной зависимости давления пара над жидким P. lgp(Па) = 1,28-39400/T(2348
37,2 Дж/(моль∙К); уравнение температурной зависимости давления пара над жидким P. lgp(Па) = 1,28-39400/T(2348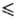 Т
Т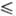 3058 К); температурный коэф. линейного расширения 6,7∙10−6 К−1 (293–1273 К); теплопроводность 48,0 Вт/(м∙К) при 298 К, 46,6 Вт/(м∙К) при 373 К; ρ 1,93∙10−7 Ом∙м (20 °C), температурный коэф. ρ 3,9∙10−3 К−1; парамагнитен, уд. магн. восприимчивость +0,368∙10−6 (20,2 °C); работа-выхода электрона 4,8 эВ. В отличие от W Р. пластичен в литом и рекристаллизованном состоянии и деформируется на холоду. Модуль упругости 470 ГПа при 20 °C (уступает по величине лишь модулю упругости Os и Ir); твердость по Виккерсу отожженного Р. 2450 МПа, деформированного-7840 МПа; отличается высокой длит. прочностью при 1000–2000 °C.
3058 К); температурный коэф. линейного расширения 6,7∙10−6 К−1 (293–1273 К); теплопроводность 48,0 Вт/(м∙К) при 298 К, 46,6 Вт/(м∙К) при 373 К; ρ 1,93∙10−7 Ом∙м (20 °C), температурный коэф. ρ 3,9∙10−3 К−1; парамагнитен, уд. магн. восприимчивость +0,368∙10−6 (20,2 °C); работа-выхода электрона 4,8 эВ. В отличие от W Р. пластичен в литом и рекристаллизованном состоянии и деформируется на холоду. Модуль упругости 470 ГПа при 20 °C (уступает по величине лишь модулю упругости Os и Ir); твердость по Виккерсу отожженного Р. 2450 МПа, деформированного-7840 МПа; отличается высокой длит. прочностью при 1000–2000 °C.
Для Р. известны соединения со степенью окисления от +7 (наиб. устойчивы) до −1. Оксиды, галогениды, халькогениды и мн. др. соединения Р. восстанавливаются H2 до металла. Металлический Р. устойчив на воздухе при комнатной температуре. Образование оксидов P. Re2O7, ReO3- начинается при 300 °C и интенсивно протекает выше 600 °C. Во влажном воздухе Р. медленно окисляется до HReO4. P. устойчив в атмосфере H2, а также N2 даже при высоких температурах. С F2 при нагр. образует смесь ReF5, ReF6 и ReF7, с Cl2-ReCl5 и ReCl4, с Br2-ReBr5, с I2 не реагирует. Взаимод. порошков Р. и графита при 1000 °C и давлении 920 кПа получен карбид ReC. С парами боранов или галогенидов В при 1750 °C и выше образует бориды. Р. не корродирует в H2SO4, соляной и фтористоводородной кислотах при комнатной температуре. В HNO3, горячей H2SO4 и в H2O2 раств. с образованием HReO4. С растворами щелочей реагирует медленно, с расплавами быстро (особенно в присутствии окислителей), давая ренаты(VII) MReO4. P. устойчив в расплавл. Sn, Zn, Ag, Cu, Bi, слабо раств. в расплавл. А1 и легко — в расплавах Ni и Fe. При восстановлении аммиаком NH4ReO4 или ReCl3 при 300–350 °C получен нитрид ReN0,43 (решетка гране-центрированная кубич., а = 0,392 нм; разлагается при нагр. до 280 °C в вакууме).
С фосфором выше 750–800 °C Р. образует фосфиды ReP3, ReP2, ReP и Re2P, с As-арсенид ReAs2,1–2,3, с Si при спекании-силициды ReSi, Re3Si, Re2Si, а также ReSi2 (решетка тетрагон., а = 0,3131 нм, с = 0,7676 нм; полупроводник).
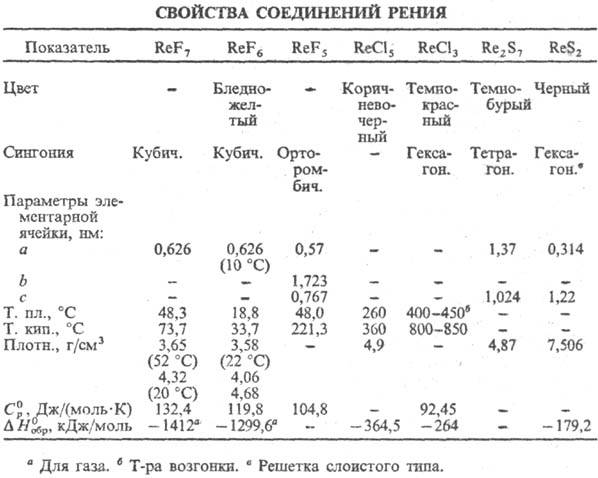
Устойчивые сульфиды P.-Re2S7 и ReS2 (см. табл.); окисляются HNO3, H2O2 и др. до HReO4. Сульфид Re2S7 при 500–600 °C сгорает на воздухе до Re2O7; почти не раств. в воде и соляной кислоте; получают при длит, пропускании H2S через солянокислый раствор рената(VII) щелочного металла. ReS2 устойчив на воздухе до 180–200 °C, выше 300 °C сгорает до Re2O7; не раств. в H2SO4, соляной кислоте и растворах щелочей; получают взаимод. порошка Р. с S при 900–1000 °C в запаянной вакуумированной трубке или атмосфере инертного газа, а также разложением Re2S7 в вакууме. Известны также ReS3, Re2S3, ReS, оксисульфиды ReO2S3, ReOS. Аналогично сульфидам получают селениды Re2Se7 и ReSe2 (плотн. 8,27 г/см3). Сульфиды и селениды Р. — эффективные катализаторы гидрирования орг. веществ.
Р. — единств. металл, образующий устойчивый гептафто-рид ReF7 (см. табл.); температура полиморфного перехода −110 °C; 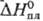 5,45 Дж/моль,
5,45 Дж/моль, 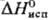 31,8 кДж/моль;
31,8 кДж/моль; 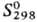 354,9 Дж/(моль∙К); уравнения температурной зависимости давления пара: lgp(Па) = 5,1524–1,4703 lgT-2205,8/Т (258,68
354,9 Дж/(моль∙К); уравнения температурной зависимости давления пара: lgp(Па) = 5,1524–1,4703 lgT-2205,8/Т (258,68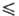 Т
Т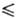 321,45 К), lgp(Па) = 29,4743 + 9,90825 lgT-244,28/Г(321,45
321,45 К), lgp(Па) = 29,4743 + 9,90825 lgT-244,28/Г(321,45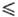 Т
Т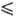 347,76 К); быстро гидролизуется водой до HF и HReO4. Гексафторид ReF6 — кубич. форма переходит в ромбическую при −3,45 °C, ΔHперехода 4,40 кДж/моль,
347,76 К); быстро гидролизуется водой до HF и HReO4. Гексафторид ReF6 — кубич. форма переходит в ромбическую при −3,45 °C, ΔHперехода 4,40 кДж/моль, 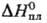 4,56 кДж/моль,
4,56 кДж/моль, 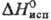 28,3 кДж/моль; легко гидролизуется, во влажном воздухе образует ReO2; в присутствии следов влаги превращ. в ReOF4; хорошо раств. в безводном HF. Пента-фторид ReF5 (,
28,3 кДж/моль; легко гидролизуется, во влажном воздухе образует ReO2; в присутствии следов влаги превращ. в ReOF4; хорошо раств. в безводном HF. Пента-фторид ReF5 (, 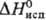 50,3 кДж/моль) взаимод. с CCl4, гидролизуется водой; получают восстановлением ReF6 водородом, Si, W или Re, а также PF3. Тетрафторид ReF4-кристаллы с тетрагон. решеткой (а = 1,012 нм, с = 1,595 нм); возгоняется выше 300 °C; получают восстановлением ReF6 рением, H2, SO2 либо при диспропорционировании ReF5.
50,3 кДж/моль) взаимод. с CCl4, гидролизуется водой; получают восстановлением ReF6 водородом, Si, W или Re, а также PF3. Тетрафторид ReF4-кристаллы с тетрагон. решеткой (а = 1,012 нм, с = 1,595 нм); возгоняется выше 300 °C; получают восстановлением ReF6 рением, H2, SO2 либо при диспропорционировании ReF5.
Из хлоридов Р. наиб. изучены ReCl5 и ReCl3, из оксохло-pидов-ReOCl4, ReO3Cl. Пентахлорид ReCl5 в атмосфере инертного газа выше 600 °C диссоциирует на Re и Cl2, при 190–360 °C-на Cl2 и ReCl3; во влажном воздухе дымит, в воде диспропорционирует на производные Re(IV) и Re(VII); при нагр. реагирует с O2 со вспышкой, образуя оксохлориды. Трихлорид ReCl3 при 400–450 °C сублимируется с разложением, при 800–850 °C испаряется без разложения, выше 1000 °C диссоциирует на Re и Cl2; 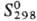 123,9 Дж/(моль∙К); на воздухе при комнатной температуре устойчив, в присутствии влаги образует дигидрат ReCl3-2H2O, при нагр. на воздухе или в среде O2 дает оксохлориды и Cl2; получают термич. диссоциацией ReCl5 или разложением хлорорената серебра. Среди важнейших кислородных соединений Р. — рениевая кислота HReO4 (см. рения оксиды) и ее соли-ренаты (VII), образующиеся при взаимодействии HReO4 со щелочами, оксидами или карбонатами металлов. Плохо раств. в воде ренаты Т1, К, Rb, Cs, Ag, умеренно-соли NH4, Pb, хорошо — соли Na, Mg, Ca, Fe, Cu и др.
123,9 Дж/(моль∙К); на воздухе при комнатной температуре устойчив, в присутствии влаги образует дигидрат ReCl3-2H2O, при нагр. на воздухе или в среде O2 дает оксохлориды и Cl2; получают термич. диссоциацией ReCl5 или разложением хлорорената серебра. Среди важнейших кислородных соединений Р. — рениевая кислота HReO4 (см. рения оксиды) и ее соли-ренаты (VII), образующиеся при взаимодействии HReO4 со щелочами, оксидами или карбонатами металлов. Плохо раств. в воде ренаты Т1, К, Rb, Cs, Ag, умеренно-соли NH4, Pb, хорошо — соли Na, Mg, Ca, Fe, Cu и др.
• см. также ренийорганические соединения
Получение. Осн. сырьевые источники Р. — молибденитовые концентраты (содержание Р. 0.01–0,04%), медные концентраты некоторых месторождений (0,002–0,003% Р.), отходы от переработки медистых сланцев (напр., свинцово-цинковые пыли, содержащие 0,04% Р.), а также сбросные воды гидро-металлургич. переработки бедных молибденитовых концентратов (10–50 мг/л Р.). При окислит. обжиге молибденитовых концентратов при 550–650 °C Р. удаляется на 50–95% с печными газами в виде Re2O7. Он концентрируется в шла-мах в растворах, образующихся при очистке пылеуловит. систем. Для извлечения Р. из молибденитовых концентратов используют также гидрометаллургич. методы. На разл. стадиях производства черновой меди Р. также удаляется с отходящими газами. Если печные газы направляются в производство H2SO4, Р. концентрируется в промывной кислоте электрофильтров. Для извлечения Р. из пылей и шламов применяют выщелачивание слабой H2SO4 или водой с добавкой окислителя (MnO2).
Из растворов Р. извлекают в осн. сорбционными (с применением слабо- и сильноосновных ионитов) и экстракционными (экстрагенты-триалкиламин, трибутилфосфат и др.) методами. В результате десорбции или реэкстракции растворами NH3 образуется NH4ReO4, восстановлением которого водородом получают порошок Р. Восстановление осуществляют в две стадии: первую — при 300–350 °C, вторую — при 700–800 °C. Порошки прессуют в штабики, их спекают при 1200–1300 °C, а затем при 2700–2850 °C в токе H2. Спеченные штабики уплотняют ковкой или прокаткой на холоду с промежут. отжигами. Для получения компактного Р. применяют также плавку в электроннолучевых печах.
Определение. Качественно Р. обнаруживают хим., физ.-хим. и физ. методами. Пары Re2O7 и все летучие соединения Р. окрашивают пламя в бледно-зеленый цвет. Для качеств. обнаружения используют микрохим. реакции с метиленовым голубым, ацетатом бруцина, нитратом стрихнина, ацетатом нитрона, хлоридом трипафлавина, солями К, Rb, Cs, Tl, Ag и др.; предел обнаружения 0,10–0,25 мг Р. Количественно Р. определяют гравиметрии., титриметрич., электрохим., спект-рофотометрич. (до 10−2–10−5% по массе), спектральными (до 10−4–10−5% по массе), флуоресцентными, рентгено-спектральным (до 5∙10−8%), радиоактивационными (особенно нейтронно-активационным), масс-спектрометрич. (10−7%) и др. методами. Гравиметрич. способы основаны на осаждении ренатов (VII) нитрона и тетрафениларсония, а также Re2S7. Среди титриметрич. методов используют алка-лиметрич. титрование HReO4, окислит:-восстановит. и комплексонометрич. титрование. Спектрофотометрич. методы основаны на образовании в кислых растворах окрашенных соед. Re(V) и Re(IV). В щелочных растворах Р. определяют по светопоглощению ренатов (VII) щелочных металлов и тетрафениларсония.
Применение. Ок. 65% производимого в мире Р. идет на получение Pt-Re катализаторов для нефтеперерабатывающей промышленности (получение бензина с высоким октановым числом). Р. — компонент жаропрочных сплавов на основе W — Mo, а также сплавов на основе Ni, Cr, Mo, Ti; материал для электрич. контактов, покрытий, термопар (Pt-Re, Mo-Re, W-Re), рентгеновских трубок, вакуумных ламп, ламп-вспышек, измерит. аппаратуры; перспективный конструкц. материал для атомных реакторов, использующих Na в качестве теплоносителя. На реакции β-распада 187Re основан рений-осмиевый метод определения возраста горных пород и метеоритов. Искусственно полученные изотопы 18*Re (T1/2 50 сут), 186Re (T1/2 88,9 ч) и 188Re (T1/2 16,7 ч)-изотопные индикаторы.
Растворимые соединения Р. мало токсичны. Пыль металлического Р. не вызывает интоксикации, а при введении через органы дыхания приводит к слабо текущему фиброзу.
Мировое производство Р. (без СНГ) ок. 15 т (1989), в т. ч. в Чили ок. 4,5 т (ведущий производитель Р.).
Р. открыли в 1925 В. Ноддак и И. Такке.
Лит.: Борисова Л. В., Ермаков А. Н., Аналитическая химия рения, М., 1974; Рений. Химия, технология, анализ. Труды IV Всесоюзного совещания по проблеме рения, М., 1976; Раков Э.Г., Дудин А. С., Опаловский А. А., "Успехи химии", 1980, т. 49, в. 10, с. 1945–62; Ряшенцева М.А., Миначев Х. М., Рений и его соединения в гетерогенном катализе, М., 1983; Сперанская Е. Ф., Электрохимия рения, А.-А., 1990; "Цветные металлы", 1991, № 7, с. 32–51; "Bulletin bureau mines US department of commerce", 1980, V. 671, p. 753–61; Kemmit R. D. W., Peacock R. D., The chemistry of manganese, technetium and rhenium, Oxf, 1975.
Э. Г. Раков, И. Д. Трошкина
Значения в других словарях
- Рений — (Rhenium) Re, химический элемент VII группы периодической системы Менделеева, атомный номер 75, атомная масса 186,207. Светло-серый металл. В природном... Большая советская энциклопедия
- рений — -я, м. Химический элемент, металл светло-серого цвета, по тугоплавкости уступающий только вольфраму. [По названию Рейнской области в Германии] Малый академический словарь
- рений — орф. рений, -я Орфографический словарь Лопатина
- РЕНИЙ — РЕНИЙ (символ Re), серебристо-белый ПЕРЕХОДНОЙ ЭЛЕМЕНТ, впервые обнаруженный в 1925 г. Рений встречается в МОЛИБДЕНИТАХ и рудах ПЛАТИНЫ, из которых его получают как побочный продукт. Научно-технический словарь
- Рений — Re (от лат. Rhenus — p. Pейн * a. rhenium; н. Rhenium; ф. rhenium; и. renio), — хим. элемент VII группы периодич. системы Mенделеева, ат. н. 75, ат. м. 186.207. Горная энциклопедия
- рений — РЕНИЙ -я; м. Химический элемент (Rе), тугоплавкий металл светло-серого цвета (используется в сплавах для антикоррозийных покрытий, деталей сверхзвуковых самолётов, ракет, точных приборов и т.п.). ◁ Рениевый -ая, -ое. ● По названию Рейнской области в Германии. Толковый словарь Кузнецова
- рений — рений м. Химический элемент, светло-серый тяжёлый и тугоплавкий металл, устойчивый к химическим реагентам. Толковый словарь Ефремовой
