ртутьорганические соединения
РТУТЬОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
содержат связь Hg-С. Большинство Р. с. представлено соед. Hg(II) типов RR'Hg'n RHgX (R, R'- одинаковые или различные орг. радикалы; X-Hal, остаток минер. или орг. кислоты, OH, OR:, SH, SR:, NR2 и др.) и лишь небольшое число соединениями Hg(I). Как правило, Р. с. содержат ковалентные σ-связи Hg—С, известны отдельные примеры π-комплексов Hg(I) и Hg(II).
Р. с. типа Alk2Hg-мономерные бесцв. жидкости или низкоплавкие твердые вещества [напр., для (CH3)2Hg и (C2H5)2Hg т. кип. 92 и 159 °C соотв., для (C12H25)2Hg т. пл. 45 °C] с характерным запахом, раств. в органических растворителях. Р.с. типа Ar2Hg-твepдыe вещества (напр., для Ph2Hg т. пл. 125 °C), раств. во многих органических растворителях, плохо раств. в алифатич. углеводородах. Как правило, соед. R2Hg не раств. в воде, исключения составляют соед., в которых R-фторир. радикал; при растворении последних образуются слабо проводящие растворы: (CF3)2Hg + H2O ⇄ (CF3)2Hg∙H2O → [(CF3)2HgOH]− + H+. Р.с. типа AlkHgX и ArHgX-обычно кристаллич. вещества; соед., содержащие низший алкил,-летучи; плохо раств. в воде, за исключением соед., построенных по ионному типу (X-NO3, ClO4 и др.), раств. в полярных органических растворителях, плохо раств. в алифатич. углеводородах.
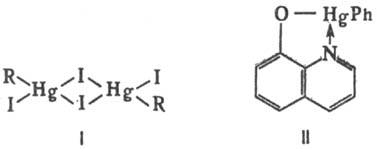
Для Р.с. наиб. характерна линейная геометрия молекул с 6sp-гибридизованными связями Hg, углы CHgC или CHgX близки к 180°. Атом Hg может увеличивать координац. число (чаще до 3 или 4, максимально до 6) в результате межмол. взаимодействия с внеш. донором электронов с образованием аддуктов 1:1 или 1:2 или соед. ассоциативного типа (напр., формулы I), а также в случаях, когда R или X содержат заместители, способные образовывать внутри-мол. координац. связь с атомом Hg. Увеличение координац. числа наиб. характерно для Р.с. с сильно электроотрицат. R и X и в сильноосновных средах, при этом могут заметно уменьшаться углы CHgC или CHgX, напр. для соед. формулы II угол CHgO 142°. Это соответствует приближению к sp2-гибридизации атома Hg.
Р. с. типа RHgX более склонны к комплексообразованию, чем R2Hg. Для аллильных, бензильных, α-карбонильных и др. родственных Р. с. возможно взаимод. легко поляризуемой σ-связи Hg—С с соседней ненасыщ. группой (σ, π-сопряжение). В циклопентадиенильных Р.с. в растворе σ-связь высоколабильна и атом Hg перемещается по цикло-пентадиенильному кольцу.
Р.с. весьма стабильны. Реакции, протекающие с разрывом связи Hg—С, м. б. гетеролитическими или гемолитическими. В гетеролитич. реакциях Ar2Hg более реакционноспособны, чем Alk2Hg, в радикальных-R2Hg более реакционно-способны, чем RHgX. Поскольку атом Hg имеет более высокую электроотрицательность, чем др. металлы II гр. (1,9 по Полингу), σ-связи Hg—С обычно ковалентны и менее полярны. Это проявляется в конфигурац. стабильности хиральных Р.с. Анионный характер атома углерода, связанного с атомом Hg, выражен слабо, поэтому Р.с. не реагируют с водой, спиртами, карбонильными соединениями.
Р. с., как правило, устойчивы к окислению атм. кислородом, однако соед., содержащие вторичный или третичный алкил, аллил, бензил, при продолжит. контакте с воздухом могут окисляться. Действие кислорода в отсутствие влаги приводит к смеси продуктов, напр.: при окислении дицикло-гексилртути в изопропаноле образуются Hg, ацетон, цикло-гексанол и циклогексанон (реакция носит радикальный характер).
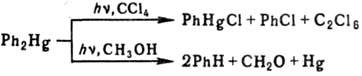
Термолиз и фотолиз Р.с. в газовой фазе идет двумя путями с выделением металлич. Hg и промежут. образованием своб. радикалов:

В зависимости от природы своб. радикала и присутствия др. субстратов могут образовываться разл. продукты; в растворе, обычно идет радикальная атака на растворитель, напр.:
Особенно легко разлагаются соед., содержащие вторичный и третичный алкил, наличие электроноакцепторных заместителей повышает стабильность Р.с., напр. т. разл. (трет-C4H9)2Hg 40 °C, соед. (C6Cl5)2Hg стабильно вплоть до т. пл. 383 °C. Соед. типа RHgX также разлагаются по радикальному механизму. Термич. разложение Р. с. катализируется переходными металлами. Разложение Р. с. используют в орг. синтезе, напр. для получения замещенных винильных производных:
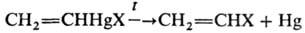
Р.с. вступают в реакции переметаллирования, напр.: R2Hg + R'M → RHgR' + RM (М-металлы Iа гр.) nR2Hg + 2M → nHg + 2RnM (М-металлы Ia, IIа и III гр. или амальгамы Sn, Bi) nR2Hg + МХn : RnM + nRHgX (М-металлы III-V гр., X-Hal, H, OAc)
Реакция Р.с. с галогенами в неполярных средах протекает как гомолитич. процесс (отсутствие стереоспецифичности), в полярных-как гетеролитический (с обращением конфигурации):
R2Hg + На12 : RHgHal + RHal RHgX + Hal2 :RHal + HgXHal
При действии на Р. с., содержащие электроноакцепторные группы, сильных электрофилов в присутствии кислот Льюиса ртуть легко замещается на алкильные или ацильные группы, напр.:
RCOCH2HgCl + Ph3CX → RCOCH2CPh3 + HgClX (RC=C)2Hg + 2R'COX → 2RC=CCOR' + HgX2
Действие минер. и орг. кислот на Р. с. типа R2Hg приводит к разрыву соотв. обеих или одной связи Hg—С; действие сильных кислот на RHgX — к замещению X на остаток кислоты (также действуют на RHgX соли металлов).
Устойчивость Р. с., возможность замещения атома Hg др. элементами и группами позволили использовать их для изучения механизма и стереохимии реакций электроф. замещения у насыщ. атома углерода.
Для получения Р. с. используют след. реакции.
1) Переметаллирование: RnМ + nHgX2 → nRHgX + МХn; 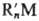 + nRHgX → nRHgR' + МХn (М — электро-положит. металл, чаще Li или Mg, реже Zn, A1, В, металлы IVб гр., As, Sb, Bi, переходные металлы, σ-связанные с R; R и R'-алкил, алкенилы, арил и др.).
+ nRHgX → nRHgR' + МХn (М — электро-положит. металл, чаще Li или Mg, реже Zn, A1, В, металлы IVб гр., As, Sb, Bi, переходные металлы, σ-связанные с R; R и R'-алкил, алкенилы, арил и др.).
2) Меркурирование (введение ртутьорг. остатка в молекулу орг. соединения): 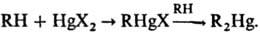
Наиб. легко меркурируются ароматич. и гетероциклич. соед., а также алифатич. соед. с подвижными атомами водорода, напр. ацетилен, насыщ. соед. с акцепторными группами и др. Меркурирование ароматич. соед. — классич. реакция электроф. замещения в ароматич. ряду, протекает по схеме (В-основание):
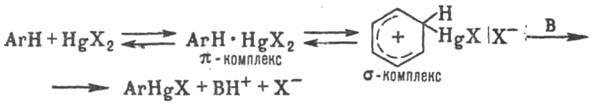
При Меркурировании ароматич. соед., содержащих электронодонорные заместители, а также фурана, тиофена и пиррола в качестве побочных продуктов образуются полимеркурированные Р. с. Реакцию меркурирования используют чаще всего для получения Р. с. типа RHgX, для соед. R2Hg необходимы более жесткие условия или присутствие оснований.
3) Сольвомеркурирование: присоединение солей Hg к непредельным соед. в присутствии нуклеофила HY (часто нуклеофилом является растворитель):
RR'C=CR:R': + HgX2 + HY → RR'CYCR:R':HgX + HX
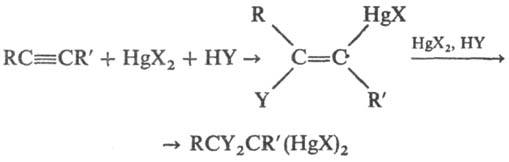
Обычно присоединение солей Hg происходит согласно правилу Марковникова как транс-присоединение. В случае алкинов при R. R' образуется смесь изомеров (присоединение м. б. цис- и транс-). Этот метод используют для получения β-замещенных RHgX.
4) Диазометод (Несмеянова реакция)-разложение двойных солей арилдиазонийгалогенидов с галогенидами Hg под действием порошка металла (напр., Cu):
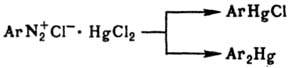
Реакция региоспецифична, дает возможность получать Р. с. практически с любыми заместителями с высокими выходами при невысоких температурах, но применима только в ароматич. ряду и для некоторых гетероциклич. соединений.
5) Разложение ртутьсодержащих производных карбоновых, сульфоновых и сульфиновых кислот в среде полярных растворителей; используют только для получения диалкил и алкиларил производных: 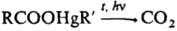 + RHgR' (R и R' = Ar, гетерил, Alk, циклоалкил).
+ RHgR' (R и R' = Ar, гетерил, Alk, циклоалкил).
Р. с. могут быть получены электрохим. синтезом-разложением металлоорг. соед. на ртутном аноде (реакция 1); разложением ненасыщ. соед. или орг. галогенидов на ртутном катоде (2), а также реакцией RI или RBr с металлич. Hg (при УФ облучении) или с амальгамой Na (3); соконденса-цией радикалов, получаемых в тлеющем разряде, и Hg при −196 °C (4); внедрением карбенов по связи Hg—Hal (5):
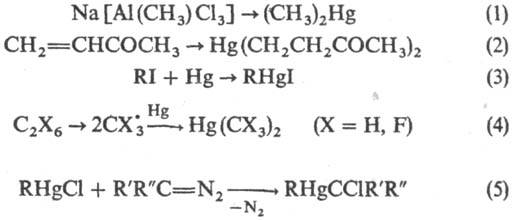
Для получения Р. с. типа R2Hg используют также реакцию симметризации Р. с. типа RHgX (реакция 6) или их восстановит. диспропорционирование (7), напр.:
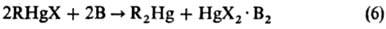
В-основание
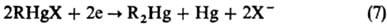
Симметризующие агенты-иодиды щелочных металлов, NH3, третичные фосфины (для ArHgX), нагревание; восстановители-Na2S2O4, Na2SnO2, гидразин, электрохим. восстановление (для гидроксимеркурированных Р. с.). Реакция симметризации стереоспецифична и протекает с обращением конфигурации по механизму SE2.
Р. с. типа RHgR' получают либо реакцией переметаллирования, либо реакцией меркурирования, напр.:
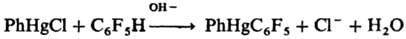
Используют также реакцию перераспределения: R2Hg + +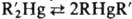 ; при этом чем больше различие в свойствах R и R', тем сильнее равновесие смещено в сторону RHgR'. При R и R' = Alk реакцию проводят в присутствии AlCl3 и длительное время, при R и R' = Ar равновесие устанавливается быстро.
; при этом чем больше различие в свойствах R и R', тем сильнее равновесие смещено в сторону RHgR'. При R и R' = Alk реакцию проводят в присутствии AlCl3 и длительное время, при R и R' = Ar равновесие устанавливается быстро.
Для получения Р. с. типа RHgX м. б. использованы реакции обмена анионами (реакция 8); десимметризации (9, реакция в отсутствие комплексообразователей обычно сдвинута вправо, исключение составляют Р. с. с сильно электроно-акцепторными заместителями, напр. алкинилами, перфтор-алкилами и др.); разрыва связей Hg—С действием На12 или НХ-кислот (10); внедрения SO2, CO2 и др. по связи Hg—С
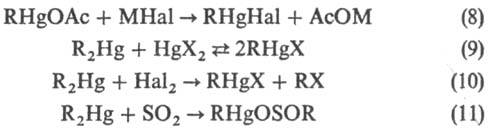
При взаимодействии C6H6, Hg2Cl2 и AlCl3 образуется π-комп-лекс Hg(I)-[(C6H6)2Hg2](AlCl4)2. Описаны π-комплексы HgHal2 с этиленом, пропеном, бутадиеном, бензолом, полученные в аргоновой матрице.
Р. с. применяют для синтеза высокочистых металлоорг. соединений. Некоторые Р. с. используют как фунгициды и протравители семян, напр. C2H5HgCl (гранозан) и его смеси с гексахлорбензолом (меркурбензол) и гексахлорциклогексаном (меркургексан).
Р. с. высокотоксичны, особенно летучие R2Hg и RHgX (R-низший алкил). Эти соед. адсорбируются кожей, сильно раздражают глаза, верх. дыхат. пути. Экология, последствия их применения такие же, как для др. сред, ртути (см. ртуть).
ПДК Р. с. по Hg обычно 0,01 мг/м3, иногда ниже, напр. ПДК C2H5HgCl 0,005 мг/м3, в воде-0,0001 мг/л, ЛД50 < < 30 мг/кг (для мьпней).
Лит.: Comprehensive organometallic chemistry, ed. by G. Wilkinson, v. 2, Oxf., 1982, p. 864–69.
А. С. Перегудов
Значения в других словарях
- Ртутьорганические соединения — Соединения, содержащие в молекуле связь углерод — ртуть (С—Hg). Известны два основных типа Р. с.: R—Hg—R' и R—HgX (R, R' — органические радикалы, X — кислотный остаток). Эти типы Р. Большая советская энциклопедия
- РТУТЬОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ — РТУТЬОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ — содержат в молекуле атом ртути, непосредственно связанный с углеродом. Известны ртутьорганические соединения типа R2Hg и RHgX, где R — органический радикал, X — галоген, OH, кислотный остаток. Большой энциклопедический словарь
