серы гексафторид
СЕРЫ ГЕКСАФТОРИД SF6
бесцветный газ; конфигурация молекулы октаэдрическая, длина связи S—F 0,1564 нм; т. пл. −50,8 °C, т. возг. −63,9 °C; температуры полиморфных переходов −228 и −177 °C, высокотемпературная кристаллич. модификация-кубическая (при −80 °C а = 0,5915 нм, пространственная группа Fm3m); tкрит 45,55 °C, pкрит 3,65 МПа; при плавлении плотн. изменяется от 2,51 до 1,85 г/см3; уравнения температурной зависимости плотн. d — 0,735 + 1,805∙10−3(45,55 — t) + 0,2065(45,55 — t)1/3 г/см3 (45,55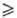 t
t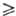 - 40 °C), давления пара lgр(атм) = 4,824 — 995/Т (222,5
- 40 °C), давления пара lgр(атм) = 4,824 — 995/Т (222,5 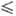 Т
Т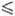 227 К);
227 К); 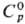 97,15 Дж/(моль∙К); ΔHвозг 22,8 кДж/моль (210 К),
97,15 Дж/(моль∙К); ΔHвозг 22,8 кДж/моль (210 К), 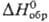 −1219 кДж/моль; 291,6
−1219 кДж/моль; 291,6 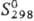 Дж/(моль∙К).
Дж/(моль∙К).
Термически устойчив до 700 °C Не раств. в воде, этаноле, эфире, образует гидрат SF6∙17H2O. He взаимод. со щелочами и кислотами. Обладает низкой теплопроводностью, хорошими диэлектрич. свойствами, что в сочетании с низкой вязкостью, относит. высокой теплоемкостью, хим. инертностью и др. делает С. г. хорошим пламегася-щим веществом. С. г. способен поглощать излучение CO2-ла-зера.
Получают С. г. взаимод. F2 с жидкой или газообразной S с послед. очисткой от примесей и конденсацией, а также реакцией F2 с SF4 в присутствии катализатора, электрохим. фторированием соед. S (напр., COS), термич. разложением SClF5 при 200–300 °C. С. г. — газообразный диэлектрик, хладагент (техн. назв. — элегаз) в трансформаторах, газонаполненных кабелях, высоковольтной аппаратуре, ускорителях электронов; реагент для плазмохим. травления полупроводников; рабочее тело в газовых хим. лазерах; его используют в высокочувствит. течеискателях, для лазерохим. разделения изотопов S. ПДК в атм. воздухе 0,001 мг/м3.
Э. Г. Раков
