соли
СОЛИ
класс хим. соединений. Общепринятого определения понятия "С.", так же как и терминов "кислоты и основания", продуктами взаимод. которых С. являются, в настоящее время не существует. С. могут рассматриваться как продукты замещения протонов водорода кислоты на ионы металлов, 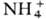 ,
, 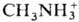 и др. катионы или групп OH основания на анионы кислот (напр., Cl−,
и др. катионы или групп OH основания на анионы кислот (напр., Cl−, 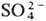 ). Продуктами полного замещения являются средние С., напр. Na2SO4, MgCl2, неполного — кислые или основные С., напр. KHSO4, CuClOH. Различают также простые С., включающие один вид катионов и один вид анионов (напр., NaCl), двойные С., содержащие два вида катионов [напр., KAl(SO4)2∙12H2O], смешанные С., в составе которых два вида кислотных остатков (напр., AgClBr). Комплексные С. (см. координационные соединения) содержат комплексные ионы, напр. K4[Fe(CN)6]. Т. наз. внутренние С, напр. бетаин (CH3)3NCH2COO−, представляют собой биполярные ионы.
). Продуктами полного замещения являются средние С., напр. Na2SO4, MgCl2, неполного — кислые или основные С., напр. KHSO4, CuClOH. Различают также простые С., включающие один вид катионов и один вид анионов (напр., NaCl), двойные С., содержащие два вида катионов [напр., KAl(SO4)2∙12H2O], смешанные С., в составе которых два вида кислотных остатков (напр., AgClBr). Комплексные С. (см. координационные соединения) содержат комплексные ионы, напр. K4[Fe(CN)6]. Т. наз. внутренние С, напр. бетаин (CH3)3NCH2COO−, представляют собой биполярные ионы.
Типичные С. — кристаллич. вещества с ионной структурой, напр. CsF (см. ионная связь, ионные кристаллы). Существуют также ковалентные С., напр. AlCl3 (см. ковалентные кристаллы). В действительности характер хим. связи у многих С. — смешанный. О правилах образования названий С. см. номенклатура химическая.
По растворимости в воде различают растворимые, мало растворимые и практически нерастворимые С. К растворимым относятся почти все С. натрия, калия и аммония, мн. нитраты, ацетаты и хлориды, за исключением солей поливалентных металлов, гидролизующихся в воде, мн. кислые С.
В водных растворах С. полностью или частично диссоциируют на ионы (см. электролитическая диссоциация). С. слабых кислот и(или) слабых оснований подвергаются при этом гидролизу. Водные растворы С. содержат гидратир. ионы (см. гидратация), ионные пары и более сложные хим. формы, включающие продукты гидролиза и др. Ряд С. раств. также в спиртах, ацетоне, амидах кислот и др. органических растворителях.
Из водных растворов С. могут кристаллизоваться в виде кристаллогидратов (см. гидраты), из неводных — в виде кристаллосольватов, напр. СаBr2∙3C2H5OH (см. сольваты). Растворы С. взаимод. с металлами, стандартные электродные потенциалы которых более отрицательны, чем потенциал металла, входящего в состав С.:
Zn + Hg(NO3)2(p_p) : Zn(NO3)2(p-p) + Hg
Из хорошо растворимых С. слабых кислот более сильные кислоты вытесняют более слабые:
CH3COONa + HCl(p-p) : CH3COOH + NaCl
Из хорошо растворимых С. слабых оснований более сильные растворимые основания вытесняют более слабые:
AlCl3(р_р) + 3NaOH(p-р) : А1(OH)3 + 3NaCl(p-p)
В водно-солевых системах между С. могут протекать обменные реакции, процессы образования труднорастворимых или комплексных С.:
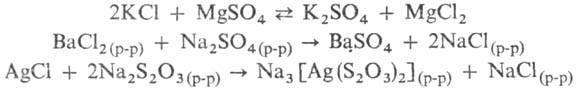
Данные о разл. процессах, протекающих в водно-солевых системах, о растворимости солей при их совместном присутствии в зависимости от температуры, давления и концентрации, о составе твердых и жидких фаз м. б. получены при изучении диаграмм растворимости водно-солевых систем (рис. 1, 2; см. также растворы, физико-химический анализ).
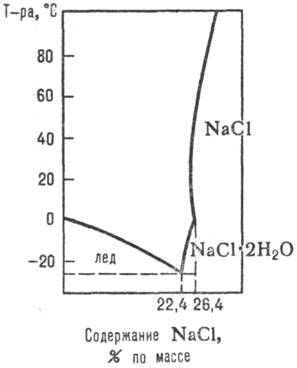
Рис. 1. Диаграмма растворимости системы NaCl-H2O.
Общие способы синтеза С. Взаимод. кислот и оснований (реакция нейтрализации, уравнение 1), а также кислот с основными оксидами (2) и оснований с кислотными оксидами (3) или кислотных и основных оксидов (4):
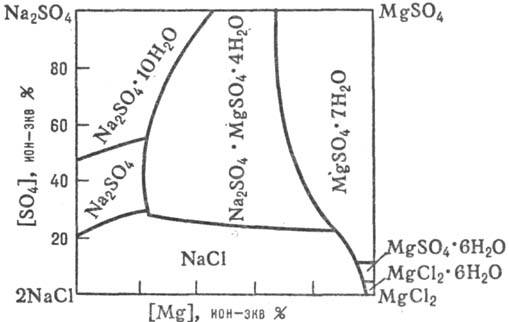
Рис. 2. Диаграмма растворимости "морской" системы 2NaCl + MgSO4 ⇄ ⇄ MgCl2 + Na2SO4 в воде при 25 °C.
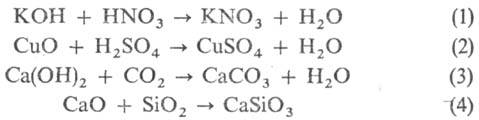
Следует отметить, что продукты взаимод. оснований и кислот Льюиса (см. кислоты и основания) отличаются от обычных С. и по отношению к ним применяют назв. "кислотно-основной комплекс" или "аддукт". Обменное взаимод. между кислотой и солью или основанием и солью (5,6):
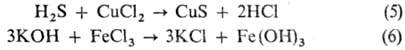
Взаимод. двух разл. солей (7), металлов с кислотами (8), металлов с неметаллами (9), металлов с солями (10):
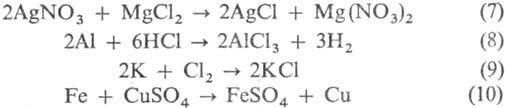
Сырьем для пром. получения ряда С. — хлоридов, сульфатов, карбонатов, боратов Na, К, Ca, Mg служат морская и океанич. вода, прир. рассолы, образующиеся при ее испарении, и твердые залежи солей (см. галургия). Для группы минералов, образующих осадочные солевые месторождения (сульфатов и хлоридов Na, К и Mg), применяют условное назв. "природные соли". Наиб. крупные месторождения калиевых С. находятся в России (Соликамск), Канаде и ФРГ, мощные залежи фосфатных руд — в Северной Африке, России и Казахстане, NaNO3-B Чили.
С. используют в пищ., хим., металлургич., стекольной, кожевенной, текстильной промышленности, в сельском хозяйстве, медицине и т. д.
• см. также бораты неорганические, галогениды, карбонаты неорганические, нитраты неорганические, сульфаты неорганические, фосфаты неорганические и др.
Лит.: Позин М. E., Технология минеральных солей, 4 изд., ч. 1 -2, Л., 1974; Бацанов С. С., Экспериментальные основы структурной химии, М., 1986, с. 195–226; Ксензенко В. И., Кононова Г. Н., Теоретические основы про-дессов переработки галургического сырья, М., 1982, с. 11–211.
В. П. Данилов
Значения в других словарях
- Соли — Класс химических соединений; кристаллические в обычных условиях вещества, для которых типична ионная структура. Согласно теории электролитической диссоциации (См. Электролитическая диссоциация)... Большая советская энциклопедия
- Соли — Соледар Топонимический словарь
- СОЛИ — СОЛИ — продукты замещения атомов водорода кислоты на металл или групп ОН основания на кислотный остаток. При полном замещении образуются средние, или нормальные, соли (NaCl, K2SO4 и др.) — при неполном замещении атомов Н — кислые (напр. Большой энциклопедический словарь
