спирты
СПИРТЫ (алкоголи)
орг. соед., содержащие в молекуле одну или неск. гидроксильных групп OH у насыщ. атомов углерода. По количеству этих групп различают одно- (иногда термин "алкоголи" относят только к одноатомным спиртам), двух- (гликоли), трех- (глицерины) и многоатомные спирты. Спирты, содержащие две группы OH у одного атома углерода (гем-диолы), как правило, неустойчивы. Некоторые из этих соед., напр. стабилизированные внутримол. водородными связями, стабильны. С. могут содержать Hal, группы NH2, СНО и CO, COOH, CN (соотв. галогена-спирты, аминоспирты, оксиальдегиды и оксикетоны, окси-кислоты, оксинитрилы). Алифатические С. могут быть первичными RCH2OH, вторичными RR'CHOH и третичными RR'R:СОН. Соед. с группой OH при двойной связи относят к енолам, а при углероде ароматич. кольца — к фенолам.
По номенклатуре ИЮПАК, название С. производят прибавлением к назв. соответствующего углеводорода суффикса "ол" либо префикса "гидрокси" для соед. со смешанными функциями или в случае, когда группа OH находится в боковой цепи, напр.: HOCH2CH2CH(CH2OH)CH2OH наз. 2-гидроксиметил-1,4-бутандиол. Многие С. имеют тривиальные назв. (см. табл.).
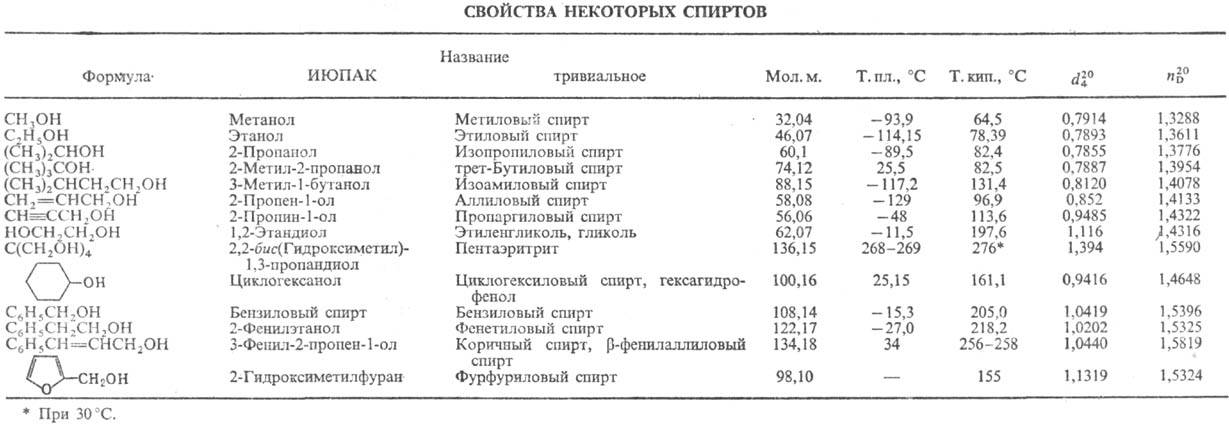
В природе С. встречаются в виде сложных эфиров (жиры, воски, эфирные масла) и в своб. состоянии. Так, 3-гексенол (т. наз. спирт листьев) содержится в зеленых листьях и фруктах, эфирных маслах, бензиловый С. — в жасминном масле, а фенетиловый С. — в розовом масле.
Свойства. С. — жидкости или твердые вещества, хорошо раств. во мн. органических растворителях. Низшие алифатические С. раств. в воде; высшие алифатич. и арилалифатические С. плохо раств. в воде.
Алифатич. спирты C1-C3 обладают характерным алкогольным запахом, C4-C5 сладковатым удушливым запахом, высшие алифатические С. без запаха, арилалифатические С. и терпеноиды, содержащие группу OH, с фруктово-цветочным запахом.
Атом кислорода гидроксильной группы имеет sp3-гибридизацию. Средние длины связей 0,143 нм (C—O) и 0,091 нм (О—Н). Обе связи полярны. Полярностью группы OH и. ее способностью образовывать водородные связи объясняют относительно высокие значения температур кипения и диэлектрич. проницаемости спиртов.
В ИК спектрах С. характеристич. полосы поглощения лежат в области 3580–3670 см−1 (своб. группа ОН). 3450–3550 см−1 (внутримол. ассоциаты), 3200–3400 см−1 (межмол. ассоциаты). В УФ и видимой областях спектра группа OH не поглощает. В спектрах ПМР хим. сдвиг группы OH d 0,5–5,5 м. д., мультиплетность сигнала зависит от характера С.: первичные С. дают триплет, вторичные-дублет, третичные-синглет. Группа OH обладает отрицат. индукционным и положит. мезомерным эффектами: константа Тафта σ* 1,55, константы Гаммета σмета 0,121, σпара — 0,37, 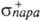 -0,853.
-0,853.
Подобно воде, С. проявляют амфотерные свойства. Величина рKa (вода, 25 °C) для CH3OH 15,1, C2H5OH 15,9, (CH3)3СОН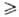 19, (CF3)3COH 5,4.
19, (CF3)3COH 5,4.
Большинство реакций С. протекает с разрывом связей О—H или C—O. Для С. характерны также реакции, в которых участвуют α-H-атом (окисление), β-H-атом (дегидратация). или d-Н-атом (окислит. циклизация).
Со щелочными, щел.-зем. и др. металлами С. образуют алкоголяты, напр.:
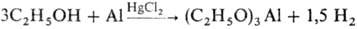
Реакция с сильными минеральными кислотами приводит либо к эфирам этих кислот (избыток кислоты), либо к простым эфирам (избыток спирта), напр.:
C3H7OH + HOSO3H C3H7OSO3H+H2O
C3H7OSO3H+H2O
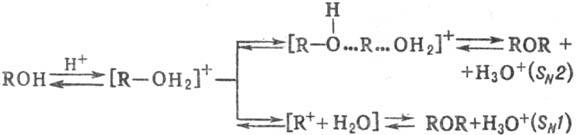
Реакция образования простых эфиров может протекать по механизмам SN2 (R и R'-первичный алкил) либо SN1 (R-mpem-алкил, аллил, бензил) в зависимости от легкости образования карбкатиона; для реакций, протекающих по механизму SN1, используют мягкие условия (разб. кислоты, по-ниж. температуру) во избежание дегидратации до олефинов. Дегидратация под действием сильных минеральных кислот идет и в случае первичных или вторичных спиртов.
Простые эфиры образуются также при дегидратации С. в присутствии катализаторов либо при их присоединении по кратным связям, напр.:
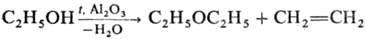
C2H5OH + CH3CH=CHCN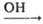 CH3CH(OC2H5)CH2CN
CH3CH(OC2H5)CH2CN
Реакция С. с альдегидами в присутствии HCl, n-толуолсульфо-кислоты и др. катализаторов приводит к ацеталям, напр.:
C2H5OH + CH3CHO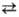 CH3CH(OC2H5)2
CH3CH(OC2H5)2
При взаимодействии С. с карбоновыми кислотами образуются сложные эфиры: реакцию проводят в избытке спирта с одновременным удалением воды в присутствии катализаторов (HCl, BF3, H2SO4 и др.); в случае первичных и вторичных спиртов катализатор активирует кислоту, в случае третичных-спирт:
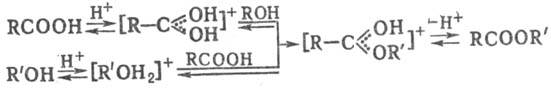
К сложным эфирам приводят также реакции С. с ангидридами, хлорангидридами, нитрилами, присоединение С. к кетенам:
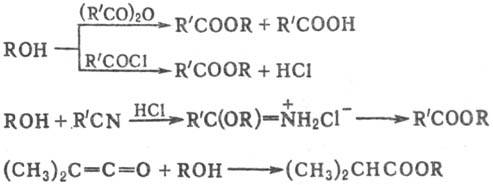
При взаимодействии С. с изоцианатами образуются уре-таны, при взаимодействии с HCl, SOCl2, PCl3 и др. происходит обмен группы OH на галоген (легче всего для третичных С.), напр.:
ROH + R'NCO → R'NHCOOR ROH + SOCl2 → RCl + HCl + SO2
Восстановление С. приводит к углеводородам, действие NH3 — к аминам (последнюю р-цкю используют в промышленности для получения низших алифатич. аминов), напр.:
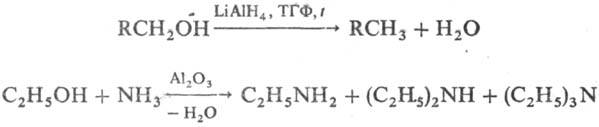
При действии окислителей (Na2Cr2O7, KMnO'4, N-бром-сукцинимид и др.) первичные С. превращаются в альдегиды (и далее в кислоты), вторичные — в кетоны (окисление вторичных спиртов в условиях реакции Оппенауэра также приводит к ке-тонам); такие же превращения могут осуществляться ката-литич. дегидрированием С. в газовой (напр., пропусканием паров С. над Cu, Ag, Cr, Ni) или жидкой фазе (над Rh, Ru, Os). Третичные С. устойчивы к окислению в нейтральных и щелочных средах, в кислой среде происходит отщепление воды и расщепление углеродного скелета с образованием кетонов или кислот с меньшим числом атомов углерода. В промышленности часто применяют каталитич. окисление С. кислородом воздуха (так получают CH2O из CH3OH, CH3CHO и CH3COOH из C2H5OH) и электрохим. окисление.
При окислении С., содержащих d-H-атом, происходит циклизация с образованием производных фурана, напр.:
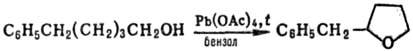
При взаимодействии C2H5OH с гипогалогенитами Na образуются соотв. хлороформ, бромоформ и йодоформ (т. наз. галоформная реакция):
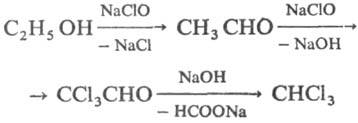
Анализ. С. дают окрашенные соед. с соед. Ce(IV), напр. аммонийцерийгексанитратом (NH4)2 [Ce(NO3)6]. Для идентификации С. используют реакции с хлорангидридами бензойной или 3,5-динитробензойной кислоты, либо с фенил-изоцианатом, приводящие к образованию хорошо кристаллизующихся эфиров бензойной кислоты или уретанов. Для количеств. определения гидроксильных групп применяют метод Церевитинова: ROH + R'MgX → ROMgX + R'H, a для смесей используют хроматографич. методы.
Получение. Получают С. гидратацией олефинов и присут. H2SO4 или H3PO4 (в осн. алканолы C2—C4); восстановлением CO на катализаторах Zn—Cr при температуре 300–400 °C и давлении 25–45 МПа (наряду с СН,ОН образуются C3H7OH, изо-C4H9OH и алканолы C5-C14); гидролизом галогенсодержащих соед.; взаимод. карбонильных соед. с реактивами Гриньяра, напр.:
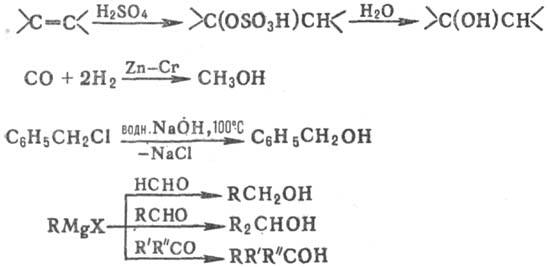
Для получения С. используют также восстановление карбонильных соед. натрием, его амальгамой, LiAlH4 в условиях реакции Меервейна — Понндорфа — Верлея, гидрирование в присутствии катализаторов (Pt, Ni) либо электролитич. восстановление.
Для пром. получения бутанола, 2-этилгексанола и пента-эритрита используют альдольную конденсацию, напр.:
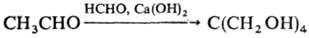
Первичные С. (в т. ч. ароматические) образуются по реакции Канниццаро либо при взаимодействии бензола с алкеноксидами в присутствии AlCl3 в условиях реакции Фриделя — Крафтса; ацетиленовые-по реакции Реппе; гидроксиэфиры — в условиях реакции Кнёвенагеля, напр.:
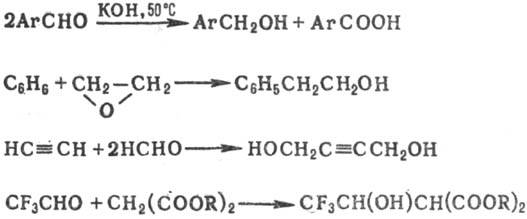
Известны др. способы синтеза С.: гидроборирование ал-кенов, гидролиз сложных эфиров, ферментативное брожение Сахаров.
Применение. Применяют С. как полупродукты в синтезе разл. орг. соед. (формальдегида, ацетальдегида, ацетона, уксусной кислоты, диэтилового эфира, сложных эфиров карбоновых кислот), в производстве красителей, синтетич. волокон, душистых веществ, лек. препаратов, моющих средств, пластификаторов и мономеров, в пищ. промышленности. С. используют как растворители, ПАВ и др., метиловый спирт также в качестве моторного топлива.
Наиб. значение имеют амиловые спирты, бензиловый спирт, бутиловые спирты, высшие жирные спирты, метиловый спирт, пентаэритрит, пропиловый спирт, β-фенил-этиловый спирт, циклогексанол, этиленгликоль, этиловый спирт.
Среди С. наиб. токсическим действием обладает метанол (смертельная доза 100–150 мл), окисляющийся в организме до формальдегида и муравьиной кислоты. Токсичность многоатомных спиртов невысока, за исключением этиленгликоля, образующего в организме ядовитую щавелевую кислоту.
Мировое производство спиртов 30 млн. т/год (1985).
Лит.: Теддер Дж., Нехватал А., Джубб А., Промышленная органическая химия, пер. с англ., М., 1977; Общая органическая химия, пер. с англ., т. 2,, М., 1982; Monick J.A., Alcohols. Their chemistry, properties and manufacture, N.Y., 1968; The chemistry of the hydroxyl group, ed. by S. Patai, L., 1971; Kirk-Othmer encyclopedia, 3 ed., v. I, N.Y., 1978.
С. К. Смирнов
Значения в других словарях
- Спирты — Производные углеводородов, содержащие в молекуле одну или несколько гидроксильных групп (—ОН) у насыщенных атомов углерода. Соединения с ОН-группами в ароматическом кольце называются Фенолами... Большая советская энциклопедия
- СПИРТЫ — СПИРТЫ, органические соединения, имеющие гидроксильную группу (-ОН), связанную с атомом углерода, например, ЭТАНОЛ (С2Н5ОН). Используются при производстве красок, духов, а также как РАСТВОРИТЕЛИ для лаков и эмалей. Научно-технический словарь
- Спирты — Органические соединения, содержащие гидроксильную группу у насыщенного атома углерода; по числу гидроксильных групп различают одноатомные (алкоголи), двухатомные (гликоли), трехатомные (глицерины) и многоатомные С.; некоторые С. являются продуктами обмена веществ в организме. Медицинская энциклопедия
- СПИРТЫ — СПИРТЫ (алкоголи) — органические соединения, содержащие гидроксильную группу ОН у насыщенного атома углерода... Большой энциклопедический словарь
