стронция галогениды
СТРОНЦИЯ ГАЛОГЕНИДЫ SrХ2, где X = F, Cl, Br, I
бесцветные кристаллы. Фторид SrF2 (см. табл.) плохо раств. в воде (0,1173 г при 17,4 °C и 0,1193 г в 1 л раствора при 27,4 °C) и разб. кислотах, раств. в горячей соляной кислоте. В криолитовых копях Гренландии найден минерал-ярлит NaF∙3SrF2 ∙ 3A1F3.
Хлорид SrCl2 раств. в воде (34,6% по массе при 20 °C, 50,2% при 100 °C); т. кип. насыщ. раствора 117 °C, из водных растворов ниже 61,34 °C кристаллизуется гексагидрат SrCl2 ∙ 6H2O, расплывающийся во влажном воздухе; при более высоких температурах гексагидрат превращ. в SrCl2∙2H2O и далее в SrCl2∙H2O; при нагр. до 250 °C полностью обезвоживается; в отличие от CaCl2∙6H2 О гексагидрат SrCl2 плохо раств. в этаноле (3,64% по массе при 6 °C), что используется для их разделения.
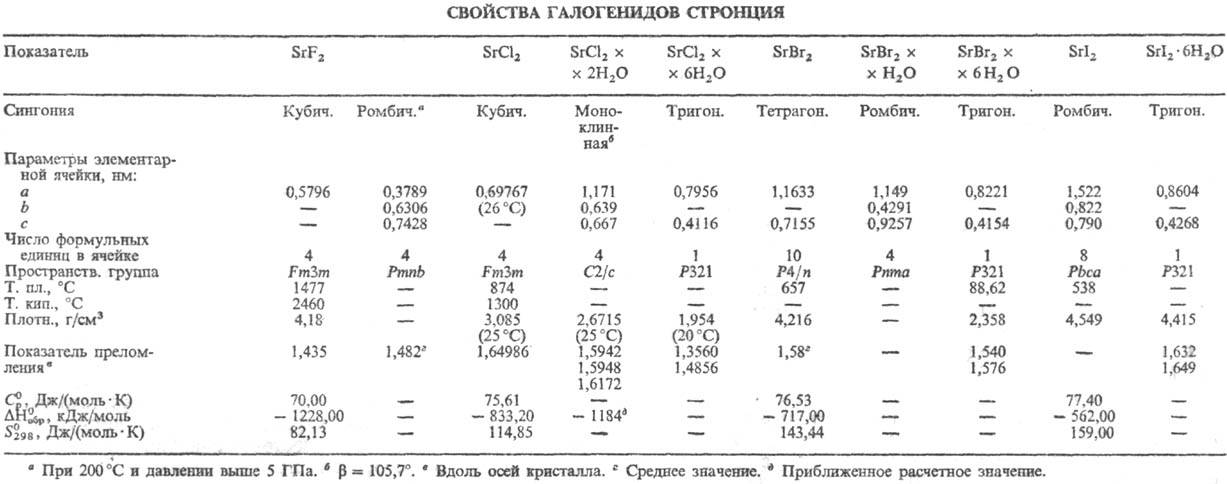
Бромид SrBr2 гигроскопичен; растворимость, % по массе: в воде-50,6 (20 °C), 69,0 (100 °C), этаноле-39,3 (30 °C), Ниже 88,62 °C из водных растворов кристаллизуется SrBr2∙6H2O, а выше этой температуры-SrBr2∙H2O; гидраты полностью обезвоживаются при 345 °C. Иодйд SrI2 имеет растворимость, % по массе: в воде-64,0 (20 °C), 79,3 (100 °C), этаноле-4,3 (39 °C), 4,7 (82 °C). Ниже 83,9 °C из водных растворов кристаллизуется SrI2∙6H2O, а выше этой температуры-SrI2∙2H2O.
С. г. образуют двойные соли, аммиакаты и др. аддукты, напр. SrCl2∙SrF2 (т. пл. 962 °C), 2KCl∙SrCl2 (т. пл. 597 °C), SrCl2∙8NH3, 2KBr∙SrBr2 (т. пл. 574 °C), SrI2∙4SO2, SrI2∙8NH3. Из водных растворов кристаллизуются SrХ2∙SrO∙9H2O, где X = Cl, Br, а также SrI2∙2SrO∙9H2O. Эвтектика LiCl-SrCl2 (48 мол. % SrCl2) образуется при 492 °C. Получают С. г. реакцией Sr с галогенами или SrO (либо SrCO3) с галогеноводородными кислотами. В газовой фазе существуют моногалогениды SrХ.
Бромид и фторид Sr-оптич. материалы, SrF2-компонент спец. стекол, люминофоров, лазерный материал, SrI2-люминесцентный материал в сцинтилляц. счетчиках; SrCl2-компонент пиротехн. составов (придает пламени карми-ново-красный цвет), его применяют в холодильной промети, медицине, косметике.
Н. С. Рукк
