сульфаты органические
СУЛЬФАТЫ ОРГАНИЧЕСКИЕ
эфиры серной кислоты. Различают алкил(арил)сульфаты — кислые эфиры серной кислоты
ROSO2OH и их соли, и диалкил(диарил)сульфаты-полные эфиры серной кислоты (RO)2SO2. Известны также орг. пиро-сульфаты-соед. типа ROSO2OSO2X и циклич. сульфаты.
Называют. C.O., прибавляя суффикс "сульфат" к названию орг. радикалов, напр. (C2H5О)2SO2-диэтилсульфат; CH3OSO2OC2H5 — метилэтилсульфат; CH3OSO2OH — метилгидросульфат, иди метилсульфат. Для кислых эфиров серной кислоты используют также назв. алкил(арил)серные кислоты. В полифункцион. соединении группу OSO2 называют сульфонилокси, напр. ClSO2O(CH2)2COOH-3-хлорсульфо-нилоксипропионовая кислота.
В ИК спектрах С. о. присутствуют характеристич. полосы в областях 1420–1380 и 1200–1150 см−1, соответствующие колебаниям группы SO2.
С. о. — высококипящие жидкости или твердые вещества (см. табл.); алкилсульфаты и их соли, а также низшие диалкил-сульфаты раств. в воде.

Алкил(арил)сульфаты малостабильны и существуют в виде равновесной смеси ROSO2OH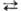 (RO)2SO2 + H2SO4 (равновесие м. б. смещено вправо путем отгонки диалкил-сульфата); являются сильными кислотами, при действии оснований образуют стабильные соли.
(RO)2SO2 + H2SO4 (равновесие м. б. смещено вправо путем отгонки диалкил-сульфата); являются сильными кислотами, при действии оснований образуют стабильные соли.
Гидролизуются С. о. до спиртов; щелочной гидролиз протекает преим. с разрывом связи C—O (механизм SN2), кислотный — с разрывом связи S—О (механизм SN1). Скорость гидролиза полных эфиров значительно больше, чем кислых; диарилсульфаты устойчивее к гидролизу, чем диал-килсульфаты.
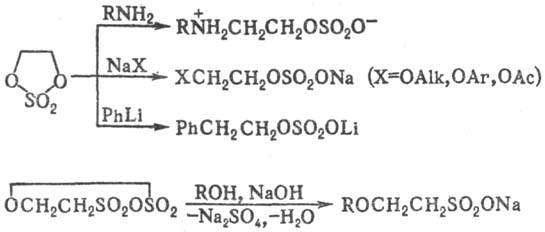
С. о. реагируют с нуклеоф. реагентами с разрывом связи C—O, благодаря чему они широко используются в орг. синтезе в качестве алкилирующих агентов для спиртов (алкоголятов), тиолов, аминов, амидов и солей карбоновых кислот, галогенидов металлов, металлоорг. соединений (карб-анионов), ароматич. соединений и т. п. В диалкилсульфатах быстро реагирует одна алкильная группа; уходящая группа ROSO2O− относительно инертна. Наиб. высокой реакц. способностью обладают циклические С. о., напр. этилен-сульфат применяют в орг. синтезе для введения группы CH2CH2OSO2O, карбилсульфат (этан-р-дисультон) — в качестве сульфоэтилирующего реагента:
Диалкилсульфаты сульфируют ароматич. соединения, вступают в реакции переалкилирования, напр.:
(RO)2SO2 + ArH:ArSO2OR + ROH
(CH3O)2SO2 + CH3COOCH2CH2OC(O)CH3:
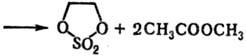
Алкилсульфаты, имеющие 2 и более атома С в алкильной группе, подвергаются термич. разложению с образованием алкенов:
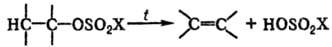
Наиб. склонностью к разложению обладают соед., содержащие трет-алкилы. Так, ди(трет-бутил)сульфат медленно разлагается уже при комнатной температуре.
Ацилсульфаты в чистом виде не выделены (за исключением перфторацилсульфатов), однако они применяются в качестве промежуточных продуктов в орг. синтезе. Например, ацетилсульфат в зависимости от природы субстрата проявляет сульфирующее (ароматич. и гетероциклич. соед., кетоны), сульфатирующее (спирты), ацетилирую-щее (амины, фенолы) или смешанное действие (алкены), напр.:
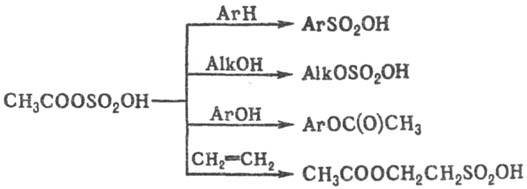
Осн. методы получения С. о. 1) Сульфатирование алкенов H2SO4-пром. метод синтеза алкил- и диалкилсульфатов. Присоединение H2SO4 происходит по правилу Марковникова:
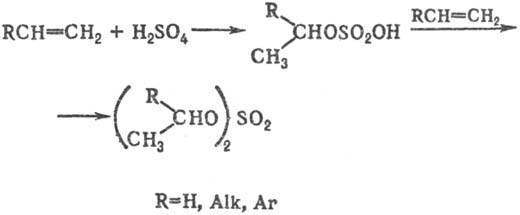
трет-Алкилсульфаты в этих реакциях вьщелить не удается; при гидролизе реакц. массы образуются соответствующие третичные спирты.
Реакция этилена с SO3 используется в промышленности для получения карбилсульфата:

2) Сульфатирование спиртов и др. гидроксилсодержащих соединений. При использовании конц. H2SO4 процесс обратим, напр.: C2H5OH + H2SO4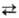 C2H5OSO2OH + H2O.
C2H5OSO2OH + H2O.
Для сдвига равновесия вправо применяют избыток H2SO4 либо удаляют воду отгонкой или с помощью дегидратирующих агентов. При переходе от первичных к вторичным спиртам скорость реакции снижается на порядок. Метод непригоден для получения трет-алкилсульфатов. Сульфатирование с помощью SO3 (ROH + SO3 → ROSO2OH) осуществляется либо его парами, либо в инертных растворителях (CCl4, SO2, CS2 и др.), или комплексами. SO3 с орг. основаниями (третичные амины, диметилформамид, диоксан и т. п.). В качестве сульфатирующих агентов используют также галогенсульфоновые кислоты, сульфаминовую кислоту или ацетилсульфат. При сульфатировании фенолов во избежание реакции в ядро применяют мягкие сульфатирующие реагенты (сульфаминовую кислоту или комплексы SO3 с аминами). При взаимод. спиртов с SO2Cl2 образуются алкил(арил)хлорсульфаты и далее диалкил(диарил)сульфаты:
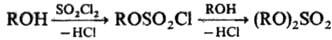
Этим методом получают трет-алкилзамещенные сульфаты, напр. ди (трет-бутил)сульфат.
В качестве сульфатирующего агента для гидропероксидов или в реакциях сульфоокисления можно применять SO2:
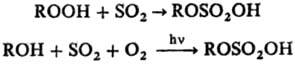
Сульфатирование высших спиртов используют в пром. производстве ПАВ (см. алкилсульфаты). Сульфатирование гидроксильных групп широко применяют в промышленности для модификации разл. веществ.
3) Расщепление простых эфиров при действии на них H2SO4 или галогенсульфоновых кислот, напр.:
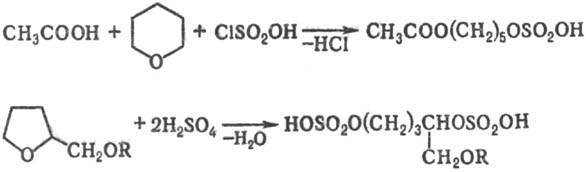
Взаимод. простых эфиров с SO3 приводит к диалкилсульфатам (реакция протекает через стадию образования комплекса), напр.:
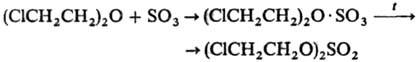
Этот способ применяют также для синтеза циклических С.о., напр.:
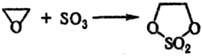
4) Сульфатирование фенолов, ароматич. аминов, хинонов. Фенолы и ароматич. амины сульфатируются персульфатами калия или аммония в ядро, образуя n-гидрокси- или n-аминофенилсульфаты (промежут. стадия реакции Эльбса), напр.:
C6H5OH + K2S2O8 → n-HOC6H4OSO2OK + KHSO4
Сульфатирование хинонов в ядро осуществляют действием SO3 в присутствии аминов; этот способ используют в промышленности для получения водорастворимых форм антра-хиноновых красителей.
5) Циклические С. о. получают: окислением циклич. сульфитов; реакцией SO3 с формальдегидом или др. альдегидами, не имеющими α-H-атома; фотохим. присоединением SO2 к o-хинону или его аналогам, напр.:
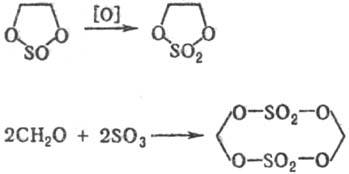
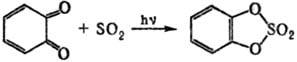
Качеств. и количественное определение С. о. основано на их гидролизе с послед. определением соответствующего спирта и сульфатной группы.
С. о. широко используют в орг. синтезе в качестве алкилирующих агентов. Соли высших алкилсульфатов -ПАВ разл. назначения (эмульгаторы, смачиватели и т. п.). Введение сульфатных групп в структуру целлюлозы, сахаров, биологически активных веществ, красителей и др. веществ применяют для получения их водорастворимых форм. Физиол. активность С.о. обусловлена их алкилирующим действием по отношению к белкам и углеводам в сочетании с гидролизом до ROSO2OH и H2SO4.
Низшие диалкилсульфаты в парах раздражают слизистые оболочки глаз и верх. дыхат. путей, в больших концентрациях поражают легочную ткань, в жидком состоянии вызывают раздражение и некроз кожи, при попадании внутрь обладают общеядовитым действием: Алкил- и арилсерные кислоты действуют на организм подобно др. сильным кислотам. Высшие алкилсульфаты и диалкилсульфаты малотоксичны.
• см. также диметилсульфат, метилсерная кислота
Лит.: Джильберт Э. Э., Сульфирование органических соединений, пер. с англ., М., 1969; Сигэру Оаэ, Химия органических соединений серы, пер. с япон., М., 1975; Общая органическая химия, пер. с англ., т. 5, М., 1983, с. 556–62.
А. Ф. Ермолов
