сульфиды неорганические
СУЛЬФИДЫ НЕОРГАНИЧЕСКИЕ
соед. серы с металлами, а также с более электроположит. неметаллами. Бинарные сульфиды (С.) могут рассматриваться как соли сероводородной кислоты H2S (см. сероводород) — средние, напр. 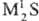
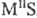
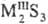 , и кислые, или гидросульфиды, MHS, M(HS)2. Существуют полисульфиды, содержащие связи S—S, напр.:
, и кислые, или гидросульфиды, MHS, M(HS)2. Существуют полисульфиды, содержащие связи S—S, напр.: 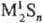 и,
и, 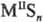 где n > 1,
где n > 1, 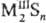 , где n > 3.
, где n > 3.
Известны также двойные С., напр. фазы Шеврёля , Ag3AsS3, CuSbS2, некоторые из них используют как полупроводниковые материалы, оксисульфиды переходных металлов MOS и M2O2S, сульфидогалогениды, напр. SbSI (сегнетоэлектрик).
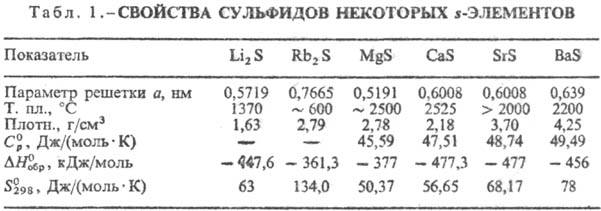
По типу хим. связи С. можно разделить на три осн. группы. К первой относят С. s-элементов-щелочных и щел.-зем. металлов, Mg, для которых характерна ионно-кова-лентная связь с некоторым преобладанием ионной составляющей. M2S кристаллизуются в структуре типа антифлюорита, МIIS — в структурах типа NaCl с высокими координац. числами для S(6, 8). Эти С. имеют относительно высокие ΔHобр, температуры плавления (табл. 1), солеподобны, бесцветны, гигроскопичны. Многие из них раств. в воде с разложением (С. щелочных металлов, BaS), образуют кристаллогидраты. Окисляются кислородом воздуха, H2O2 и др. до сульфатов, легко разлагаются HCl, HNO3 и H2SO4 на холоду. Полисульфиды химически менее стойки, чем простые С., причем их устойчивость уменьшается с повышением содержания в них S. При нагр. легко разлагаются на S и простые С.
Ко второй группе относят С. d-металлов и f-металлов с составами MS, M5S7, M3S4, M2S3, MS2, MS3 и др. У низших С. хим. связь носит преим. металлич. характер, у высших-ионно-ковалентный.
Кристаллизуются в разл. структурах, для соед. M2S3 характерен полиморфизм. В табл. 2 представлены С. с кубич. структурой — MS (типа NaCl, пространственная группа Fm3m, z = 4) и M2S3 (типа Th3P4, пространственная группа I43d, z = 4), а также с гексагон. MS2 (типа CdI2, пространственная группа 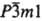 , z = 1). Термическая устойчивость С. этой группы достаточно высока и снижается с увеличением содержания S. В воде не раств., разлагаются горячими конц. HCl и H2SO4, а также бромной водой, царской водкой. Окисляются при нагревании на воздухе до оксидов и основных сульфатов.
, z = 1). Термическая устойчивость С. этой группы достаточно высока и снижается с увеличением содержания S. В воде не раств., разлагаются горячими конц. HCl и H2SO4, а также бромной водой, царской водкой. Окисляются при нагревании на воздухе до оксидов и основных сульфатов.
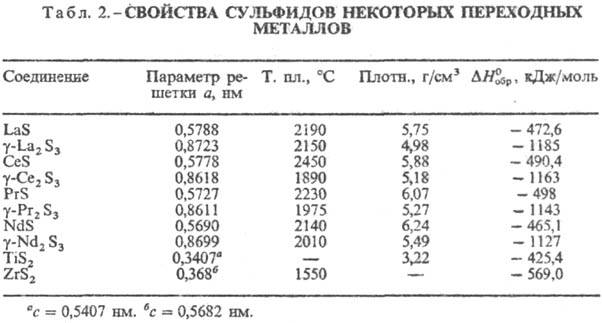
К третьей группе относят С. p-элементов (табл. 3), а также близкие к ним сульфиды Zn, Cd, Hg, Cu2S, Ag2S. Хим. связь в них ковалентно-ионная, причем вклад ковалентной составляющей повышается с увеличением номера группы. Многие из этих С. имеют сложные каркасные и слоистые кристаллич. структуры с невысоким координац. числом для атома S., Как правило, эти С. химически нестойки, мн. реагируют с влагой воздуха, легко раств. минеральными кислотами, быстро окисляются при нагр. на воздухе, в воде практически не растворяются.
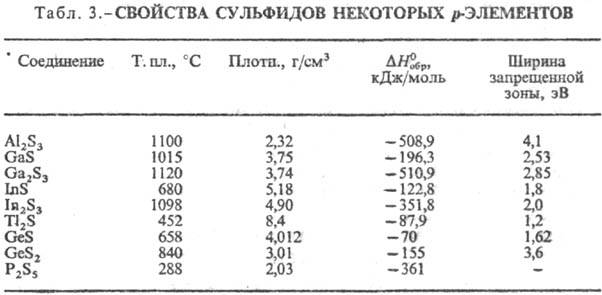
По физ. свойствам С. можно разделить на след. группы: диэлектрики (С. щелочных, щел.-зем. металлов, Mg, Al, Be); полупроводники (С. p-элементов, высшие С. d- и f-элементов, Cu2S, Ag2S, ZnS, CdS, HgS); С. с металлич. проводимостью (низшие С. d- и f-элементов MS); сверхпроводники (напр., La3S4 с критич. температурой 8,25 К, фазы Шеврёля МnMo6S8, где M-Ag, Cu и др.). Они м. б. диамагниты (С. s-и p-элементов), парамагнитны (низшие С. d- и f-элементов), антиферро-, ферри- и ферромагнитны (напр., железа сульфиды). Однако С. часто бывают нестехиометрич. соединениями, иногда с широкими областями гомогенности, что оказывает влияние на физ. свойства С.
С. получают взаимод. простых веществ в вакууме или инертной атмосфере, реакцией H2S с металлами, их оксидами, гидроксидами или солями, восстановлением сульфатов углем, H2, прир. газом, термич. разложением высших С. или их восстановлением H2. Монокристаллы выращивают направленной кристаллизацией из расплава, осаждением из паровой фазы, хим. транспортными реакциями, методом Фрерихса (взаимод. паров металла с H2S), зонной плавкой. Пленки получают осаждением из паровой фазы, методом мол.-лучевой эпитаксии, хим. осаждением из газовой фазы, осаждением из водных растворов.
Многие С. встречаются в природе в виде минералов, напр. пирит (железный колчедан) FeS2, сфалерит ZnS, халькопирит CuFeS2, галенит PbS, образуют полиметаллич. сульфидные руды.
Природные С. — исходное сырье для получения металлов, а также H2SO4 и сульфатов (FeS2). С. используют в кожев. промышленности для удаления волос со шкур (BaS, Na2S, BaS2), как основу люминофоров и полупроводники, полисульфиды Ca и Ba — для борьбы с вредителями в сельском хозяйстве, сульфиды Ba и Zn- компоненты литопона. С, некоторых РЗЭ перспективны как материалы для высокотемпературных термогенераторов, как оптич., магн. и полупроводниковые материалы.
• см. также натрия сульфиды, свинца халькогениды, сурьмы халькогениды, цинка халькогениды и др.
Лит.: Самсонов Г. В., Дроздова С. В., Сульфиды, М., 1972.
И. Н. Один
