сульфоны
СУЛЬФОНЫ
соед. общей формулы RR'SO2 (R и R'- алкил, алкенил, алкинил, арил). Известны также ди- и трисульфоны.
Назв. ациклических С. производят от назв. орг. радикалов, связанных с группой SO2, с прибавлением слова "сульфон", напр. CH3(C6H5)SO2-метилфенилсульфон; назв. циклических С. производят от назв. углеводорода, в котором один из атомов С замещен на атом S, напр. тиациклопентан-1,1-диоксид (сульфолан).
С. ограниченно распространены в природе; в крови и надпочечникад некоторых животных обнаружен диметил-сульфон.
С. — бесцв., б.ч. кристаллич. вещества, некоторые низшие алифатические С. — высококипящие жидкости (см. табл.), без запаха, хорошо раств. во мн. органических растворителях, некоторые низкомолекулярные С. раств. в воде. По сравнению с сульфоксидами С. характеризуются низкой основностью и сравнительно высокой CH-кислотностью.

В ИК спектрах С. присутствуют характеристич. полосы в области 1300–1320 и 1140–1160 см−1, соответствующие асимметрическим и симметрическим колебаниям группы SO2∙
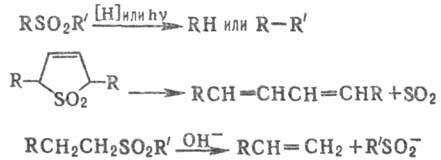
Для С. характерна высокая хим. и термич. стабильность. К большинству восстановителей С. инертны, при действии (изо-C4H9)2А1Н (в эфире или ТГФ) либо LiAlH4 на циклические С. образуются сульфиды.
С. элиминируют молекулу SO2 при УФ облучении или нагр., а также при действии некоторых восстановителей; в щелочных условиях С. подвергаются 1,2-элиминированию с образованием сульфинат-ионов, напр.:
С. вступают в реакции с диазометаном, карбонильными, галогенсодержащими и др. соед., напр.:
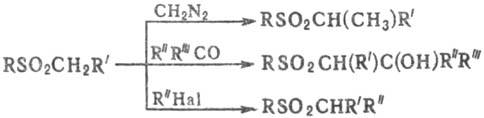
При действии сильных оснований на α-галогенсульфоны образуются алкены со строго определенным положением двойной связи (Рамберга — Бэклунда реакция).
С. легко генерируют α-сульфонилкарбанионы, которые являются синтетич. интермедиатами в реакциях галогенирования, алкилирования и др.:
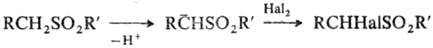
Ароматические С. подвергаются внутримол. перегруппировке под действием литийорг. соединений с образованием бензилсульфиновых кислот (см. Смайлса перегруппировка).
Получают С. окислением сульфидов или сульфоксидов (окислители-H2O2 в CH3COOH, м-хлорнадбензойная кислота, KMnO4, Na2Cr2O7 и др., реакция 1); алкилированием сульфи-новых кислот или сульфинатов (2); термич. перегруппировкой аллилсульфинатов, при этом может образовываться два разл. продукта (3), напр.:
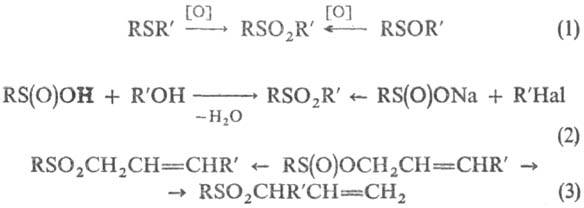
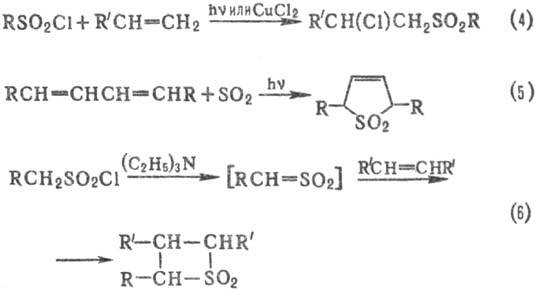
С. получают также свободнорадикальным присоединением сульфонилгалогенидов к ненасыщ. соединениям (4); цик-лоприсоединением SO2 к диенам (5); взаимод. сульфенов, генерируемых из алкансульфонилхлоридов, с алкенами (6), напр.:
Диарил- и алкиларилсульфоны получают взаимод. сульфонилгалогенидов с ароматич. соединениями в условиях реакции Фриделя — Крафтса:
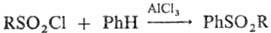
В дисульфонах группы SO2 могут находиться в α-, β- или γ-положениях. α-Дисульфоны RSO2SO2R' при кипячении в водных ρ-pax, особенно в присутствии щелочей или аминов, распадаются на сульфоновые и сульфиновые кислоты. β-Дисульфоны RS02C(R')(R:)SO2R (R-Alk, Ar, R' и R:-H, Alk, Ar) при R' = R: = H обладают кислыми свойствами, раств. в щелочах, легко замещают атом H на др. группы. γ-Дисульфоны RSO2CH2CH(R')SO2R (R и R'-Alk, Ar) под действием оснований или при нагревании отщепляют сульфино-вую кислоту и образуют β-гидроксисульфоны или непредельные С.
Для получения дисульфонов используют те же методы, что и для С.; α-дисульфоны м. б. получены также осторожным окислением тиолсульфонатов H2O2 либо сульфиновых кислот KMnO4 в CH3COOH.
Трисульфоны (RSO2)3CR' (R-Alk, Ar, R'-H, Alk, Ar) при R' = H-сильные кислоты, со щелочами образуют соли, по атому H галогенируются, нитруются. При кипячении в щелочах гидролизуются. Получают окислением (H2O2, KMnO4) тритиоортоэфиров.
Наиб. практич. применение находят ароматические С. Пластмассы на основе ариленсульфонов используют для изготовления конструкц. и электротехн. материалов. Сульфолан и сульфолен-растворители. Некоторые С. применяют в качестве лек. средств; напр., 4,4'-диаминодифенилсульфон (диафенилсульфон) и его аналог солюсульфон используют для лечения лепры (проказы).
• см. также сульфолан, сульфолены
С. в осн. малотоксичны; исключение составляют дивинил-сульфон и его предшественник — β, β'-дихлордиэтилсульфон (продукт окисления иприта).
Лит.: Сьютер Ч., Химия органических соединений серы, пер. с англ., т. 3, М., 1951; Общая органическая химия, пер. с англ., т. 5, М., 1983, с. 318–70.
А. Ф. Елеев
Значения в других словарях
- Сульфоны — Сераорганические соединения, содержащие группу , связанную с двумя органическими радикалами; бесцветные, весьма стойкие кристаллические вещества, например для дифенилсульфона (C6H5)2SO2 tпл 128 °С, tкип 379 °С. Алифатические... Большая советская энциклопедия
- Сульфоны — Производные серной кислоты SO2(OH)2 через замещение 2-х гидроксилов остатками углеводородов. Получаются окислением тиоэфиров (CnH2n+1)2S или окисей их (CnH2n+1)2SO дымящеюся HNO3 или KMnO4, или при реакции, напр.: C2H5SO2K + C2H5J = C2H5SO2C2H5 + KJ. Энциклопедический словарь Брокгауза и Ефрона
