таллий
ТАЛЛИЙ (от греч. thallos — зеленая ветка; лат. Thallium) Tl
хим. элемент III гр. периодической системы, ат. н. 81, ат. м. 204.383. Природный Т. — смесь двух изотопов: 203Tl (29,5%) и 205Tl (70,5%). Радиоактивные изотопы с мас. ч. от 206 до 210 и Т1/2 от 1,32 до 4,79 мин-члены природных радиоактивных рядов. Поперечное сечение захвата тепловых нейтронов прир. смеси изотопов 3,4∙10−28м2. Конфигурация внеш. электронной оболочки атома 6s26р1; степени окисления + 1 и + 3; энергии ионизации при переходе от Tl0 к Tl3+ 6,1080, 20,4284, 29,8 эВ; работа выхода электрона 3,70 эВ; электроотрицательность по Полингу 1,8; атомный радиус 0,171 нм, ионные радиусы, нм (в скобках указаны координац. числа): Tl1+ 0,164 (6), 0,173 (8), 0,184 (12), Tl3+ 0,089 (4), 0,103 (6), 0,112 (8).
Содержание Т. в земной коре 3∙10−4% по массе, в воде океанов 10−5 мг/л. Известно 30 таллиевых минералов, в т. ч. лорандит TlAsS2, крукезит TlCu7Se4, авиценнит Tl2O3> вследствие большой редкости не имеющие практич. значения. Т. рассеивается, являясь спутником К, в силикатах (слюды, полевые шпаты содержат ~ 0,001% Т.). Накапливается в сульфидных минералах-галените, сфалерите (до 0,1%), марказите, пирите (до 0,5%), иногда в халькопирите, киновари, сульфидах As и Sb и т. п. Иногда встречается в прир. оксидах Mn и Fe.
Свойства. Т. — белый металл с голубоватым оттенком. Низкотемпературная модификация II имеет гексагон. решетку типа Mg, а = 0,34566 нм, с = 0,55248 нм, 2 = 2, пространственная группа P62/ттс; высокотемпературная модификация I, существующая выше 234 °C, имеет объемноцентрир. кубич. решетку типа α-Fe, а — 0,3882 нм, z = 2, пространственная группа Iт3т (ΔH перехода II 10,36 кДж/моль); при давлении 3,67 ГПа и 25 °C Tl I превращ. в модификацию III с гранецентрир. кубич. решеткой, а = 0,4778 нм, z = 4, пространственная группа Fт3т. Т. пл. 303 °C, т. кип. 1475 °C, при давлении ~5 ГПа т. пл. 500 °C; плотн. 11,849 г/см3, жидкого 11,289 г/см3 (306 °C);
10,36 кДж/моль); при давлении 3,67 ГПа и 25 °C Tl I превращ. в модификацию III с гранецентрир. кубич. решеткой, а = 0,4778 нм, z = 4, пространственная группа Fт3т. Т. пл. 303 °C, т. кип. 1475 °C, при давлении ~5 ГПа т. пл. 500 °C; плотн. 11,849 г/см3, жидкого 11,289 г/см3 (306 °C); 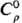 26,3 Дж/(моль∙К); ΔHпл 4,2кДж/моль, ΔHисп 181,4 кДж/моль (0 К);
26,3 Дж/(моль∙К); ΔHпл 4,2кДж/моль, ΔHисп 181,4 кДж/моль (0 К); 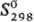 64,3 Дж/(моль∙К); уравнения температурной зависимости давления пара: lgр( мм рт. ст.) = 9,902–9511 /Т + 0,1471g Т + 0,756∙10−3T (298–576 К), lgp(MM рт.ст.) = 9,819 — 9091/T+ +0,5361gТ (576–1648 К); температурный коэф. линейного расширения 28∙10−6 К−1 (293 К); теплопроводность 38,9 Вт/(м∙К) (293 К); ρ'0,15∙10−6 Ом∙м, температурный коэф. ρ 5,177∙10−3 K−1 (273 К); температура перехода в сверхпроводящее состояние 2,39 К; диамагнитен, x —0,249∙10−9. Твердость по Моосу 1,3, по Бринеллю 20 МПа; модуль нормальной упругости 7,95 ГПа (20 °C), σраст 10 МПа; относит. удлинение 40%; пластичен.
64,3 Дж/(моль∙К); уравнения температурной зависимости давления пара: lgр( мм рт. ст.) = 9,902–9511 /Т + 0,1471g Т + 0,756∙10−3T (298–576 К), lgp(MM рт.ст.) = 9,819 — 9091/T+ +0,5361gТ (576–1648 К); температурный коэф. линейного расширения 28∙10−6 К−1 (293 К); теплопроводность 38,9 Вт/(м∙К) (293 К); ρ'0,15∙10−6 Ом∙м, температурный коэф. ρ 5,177∙10−3 K−1 (273 К); температура перехода в сверхпроводящее состояние 2,39 К; диамагнитен, x —0,249∙10−9. Твердость по Моосу 1,3, по Бринеллю 20 МПа; модуль нормальной упругости 7,95 ГПа (20 °C), σраст 10 МПа; относит. удлинение 40%; пластичен.
Стандартный электродный потенциал —0,3363 В, относительно щелочных растворов — 0,344 В. На воздухе Т. быстро темнеет и покрывается черной коркой, содержащей Tl2O Вода, не содержащая растворенного O2, на Т. не действует, в присутствии O2 растворяет его с образованием TlOH. .Т. реагирует с галогенами при комнатной температуре, при натр. — с S, Se, Те, Р. С As сплавляется без образования соединений. С H2, N2, NH3, С, Si, В, сухим CO2 не взаимодействует. Легко раств. в HNO3, неск. хуже — в H2SO4. Соляная кислота на Т. действует слабо из-за образования пленки TlCl. Со щелочами не реагирует. С этанолом в присутствии O2 образует этилат.
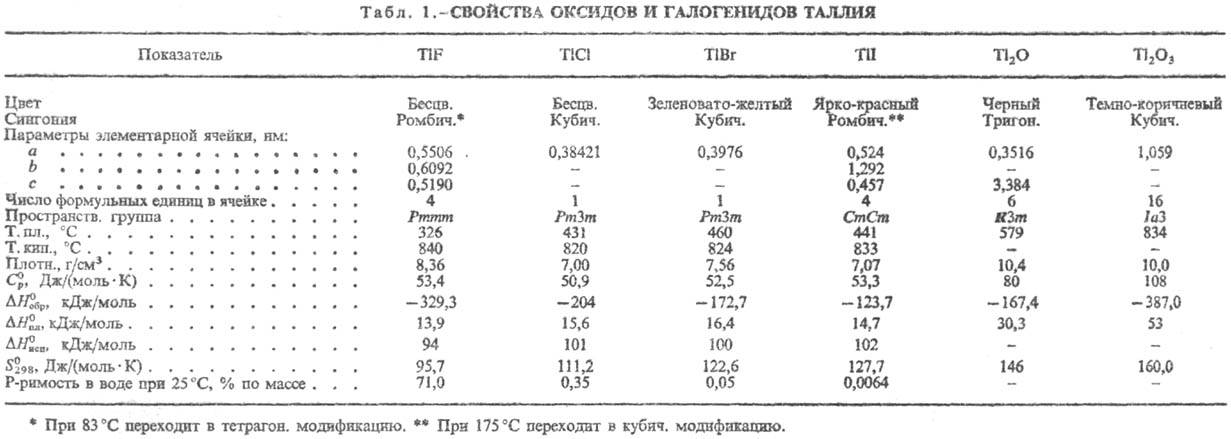
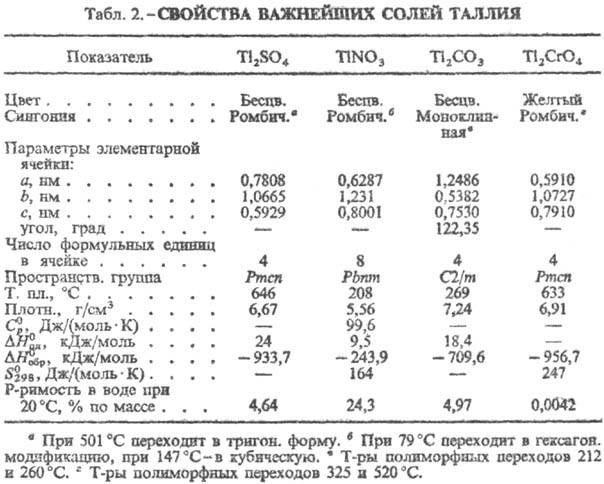
Соед. Tl(I), напоминающие по свойствам соед. К, Ag и Pb, наиб. устойчивы. Соед. Tl(III) термически малоустойчивы, легко восстанавливаются и легко гидролизуются. Tl(I) окисляется до Tl(III) при действии K2S2O7, KBrO3, KMnO4, бромной воды и т. д. Tl(III) восстанавливается в растворах до Tl(I) действием SO2, H2S, Na2S2O3, а также металлов-Zn, Fe и даже Cu. Во мн. соединениях Т. присутствует одновременно в двух степенях окисления, напр. Tl2Cl3-гекса-хлороталлат(III) таллия(l). О свойствах соед. см. табл. 1 и 2.
Оксид Tl(I) (гемиоксид) Tl2O гигроскопичен; уравнение температурной зависимости давления пара: lgp (мм рт. ст.) = = 11,51 — 6612/T(453–588 К); при натр, на воздухе окисляется; реагирует с водой с образованием ТЮН; получают окислением Т., разложением TlOH, Tl2CO3. Гидроксид TlOH-желтые кристаллы моноклинной сингонии (а = = 2,120 нм, b = 0,6240 нм, с = 0,5950 нм, β = 91,65°, z = 16); плавится инконгруэнтно при 130 °C; плотн. 7,44 г/см3;  −233 кДж/моль; растворяется в воде (20,3% по массе при 0 °C, 59,8% при 100 °C), этаноле, обладает щелочными Свойствами.
−233 кДж/моль; растворяется в воде (20,3% по массе при 0 °C, 59,8% при 100 °C), этаноле, обладает щелочными Свойствами.
Оксид Tl(III) (сесквиоксид) Tl2O3 на воздухе уже при 500 °C начинает диссоциировать, не раств. в воде и органических растворителях, раств. в разб. минеральных, а также в уксусной кислотах; получают окислением солей Tl(I) в щелочной среде H2O2 и др. методами. Производные Tl2O3-таллаты, напр. KTlO2, Ag3TlO3, Ва2Tl2O5. Гидроксид Tl2O3∙nH2O-бурое аморфное вещество; малоустойчив; почти не раств. в воде (3∙10−8% по массе при 20 °C), медленно раств. в минер. кислотах; осаждается из растворов солей Tl(III) при pH 2–4,5.
Сульфид Tl2S осаждается в виде черного осадка при действии H2S или (NH4)2S на нейтральные, щелочные или слабокислые растворы солей Т.; плохо раств. в воде (0,02% по массе при 20 °C), уксусной и щавелевой кислотах, растворах щелочей, соды, сульфидов щелочных металлов, минер. кислотами разлагается. Сульфид, полученный сплавлением Tl и S,-мягкие голубовато-черные слоистые кристаллы тритон. сингонии (а — 1,220 нм, с = 1,817 нм, z = 27, пространственная группа 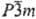 ); т. пл. 449 °C, т. кип. 1177 °C; плотн. 8,46 г/см3;
); т. пл. 449 °C, т. кип. 1177 °C; плотн. 8,46 г/см3; 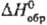 −88 кДж/моль; на воздухе, особенно в присутствии влаги, легко окисляется.
−88 кДж/моль; на воздухе, особенно в присутствии влаги, легко окисляется.
• см. также таллийорганические соединения
Получение. Осн. источники Т. — промежут. продукты я отходы кадмиевого производства, пыли свинцово-медеплавильных заводов и пиритные огарки. Обогащение Т. достигается обжигом в окислит. или восстановит. атмосфере, а также хлорирующим обжигом с добавкой NaCl или KCl. Из обогащенных возгонов Т. выщелачивается водой, разб. растворами соды или H2SO4. Иногда применяют предварит. сульфатизацию. Для концентрирования таллиисодержащих растворов и отделения Tl от Cd и др. сопутствующих элементов используют экстракцию, напр. йодным раствором трибутил-фосфата в керосине в присутствии восстановителя (SO2) с послед. реэкстракцией разб. H2SO4 в присутствии окислителя (H2O2). Из щелочных растворов концентрирование производится сорбцией на катионитах. Таллиевые концентраты получают осаждением малорастворимых соед.-TlCl, Tl2CrO4, T12O3∙nH2O и др., а также цементацией на Zn или Zn- либо Cd-амаль-гаме. Металлический Т. получают цементацией на цинковых листах или электролизом сульфатных растворов.
Очищают Т. переплавкой под слоем щелочи с добавлением окислителя (KNO3 или NaNO3) и продувкой воздуха, электролизом с растворимым анодом в сульфатном электролите. Применяют также амальгамный многосекционный электролиз с использованием сернокислотного, щелочного с добавкой трилона Б или перхлоратного электролита. Окончат. очистка достигается зонной плавкой или вытягиванием монокристаллов из расплава.
Определение. Наиб. надежный метод качеств. определения Т. — спектральный (по линии 535,0 нм). Применяют также реакции образования малорастворимых соед. — иодида (желтый осадок), иодовисмутата (красный) и др. Количественно Т. определяют: гравиметрически-осаждением тионалидом (2-меркапто-N-2-нафтилацетамид), титриметрически — титрованием Tl(I) окислителями (перманганатом, броматом, иодатом К), амперометрическим титрованием растворами K2CrO4 или KI, комплексометрич. титрованием; фотоколо-риметрически-чаще с использованием реакции галогенидных комплексов Tl(III) с красителями (метилфиолетовым, родамином Б или С, бриллиантовым зеленым). Применяются также полярографич., пламенно-фотометрич. и др. методы.
Применение. Металлический Т. используют в осн. для производства подшипниковых и кислотоупорных сплавов (на основе Pb и Sn). Амальгаму Т. [т. пл. для эвтектики Hg-Tl (8,55 ат. % Т.) −59 °C] применяют в термометрах для низких температур. Радиоизотоп 204Tl (Т1/2 3,56 г) используют в качестве источника β-излучения.
Галогениды Т. и их твердые растворы применяют для изготовления линз и др. деталей приборов ИК техники, легирования кристаллов галогенидов щелочных металлов (для сцинтилляц. счетчиков), наполнения газоразрядных ламп зеленого света. Халькогениды Т. входят в состав разл. полупроводников, в частности стеклообразных. Сульфид Т. применяют для изготовления фотосопротивлений. Соли (нитрат, карбонат) используют в производстве оптич. стекла. Формиат и малонат Т. — компоненты тяжелых жидкостей (жидкость Клеричи), используемых для минералогич. исследований. Сложные оксиды, напр. TlВа2Ca3Cu4O11,-высокотемпературные сверхпроводники.
Мировое производство Т. (без СНГ) 12–15 т/год. Осн. производители: ФРГ, США, Канада, Франция, Бельгия.
Как сам Т., так и его соед. высокотоксичны. Симптомы отравления-поражение нервной системы, почек, желудка, выпадение волос. ПДК в воде для Т. 0,0001 мг/м3, для бромида, иодида, карбоната (в пересчете на Т.) в воздухе рабочей зоны 0,01 мг/м3, в атм. воздухе 0,004 мг/м3.
Хранят Т. под слоем прокипяченной дистиллированной воды либо парафина или покрывают лаком.
Т. открыт спектроскопически У. Круксом в 1861 и получил назв. по цвету своей спектральной линии. Металлический Т. получен в том же году независимо В. Лями.
Лит.: Коренман И. М., Аналитическая химия таллия, М.7 1960; Григорович А.Н., Таллий и его промышленное получение, А.-А., 1960; Куль-ба Ф. Я., Миронов В. Е., Химия таллия. (Комплексные соединения), Л., 1963; Федоров П. И., в кн.: Химия и технология редких и рассеянных элементов, под ред. К.А.Большакова, т. 1, 2 изд., М., 1976, с. 325–66; Федоров П. И., Мохосоев М. В., Алексеев Ф. П., Химия галлия, индия и таллия, Новосиб., 1977; Lee A. G., The chemistry of thallium, Amst, 1971 (Topics in inorganic and general chemistry, v. 14).
П. И. Федоров
Значения в других словарях
- Таллий — (лат. Thallium) Tl, химический элемент III группы периодической системы Менделеева, атомный номер 81, атомная масса 204,37; на свежем разрезе серый блестящий металл; относится к редким рассеянным элементам. Большая советская энциклопедия
- таллий — -я, м. Химический элемент, серебристо-белый с сероватым оттенком металл, мягкий и легкоплавкий, имеющий в спектре яркую зеленую линию. [От греч. θαλλός — молодая зеленая ветвь, побег] Малый академический словарь
- таллий — орф. таллий, -я Орфографический словарь Лопатина
- таллий — Та́лл/ий/. Морфемно-орфографический словарь
- ТАЛЛИЙ — ТАЛЛИЙ (символ Тl), блестящий металлический элемент III группы периодической таблицы. Открыт в 1861 г. Мягкий и пластичный, добывается как побочный продукт переработки свинцовых или цинковых руд. Научно-технический словарь
- Таллий — Tl (лат. Thallium * a. thallium; н. Thallium; ф. thallium; и. talio), — хим. элемент 111 группы периодич. системы Менделеева, ат. н. 81, ат. м. 204,38З. Природный... Горная энциклопедия
- таллий — Т’АЛЛИЙ, таллия, мн. нет, ·муж. (от ·греч. thallos — росток) (·хим. ). Химический элемент, белый мягкий металл. Толковый словарь Ушакова
- таллий — ТАЛЛИЙ -я; м. [от греч. thallos — молодая зелёная ветвь, побег] Химический элемент (Тl), серебристо-белый с сероватым оттенком металл, мягкий и легкоплавкий (применяется как компонент сплавов, для амальгам). ◁ Таллиевый, -ая, -ое. Толковый словарь Кузнецова
- Таллий — (хим.; Thallium; по Круксу, 1873 г., и согласно с Лепьерром, 1893 г., Tl = 204,1, если О = 10) — дает две степени окисления, окись Tl2О3 и закись Τl2O. Энциклопедический словарь Брокгауза и Ефрона
- таллий — Таллия, мн. нет, м. [от греч. thallos – росток] (хим.). Химический элемент, белый мягкий металл. Большой словарь иностранных слов
- ТАЛЛИЙ — ТАЛЛИЙ (лат. Тhallium) — Tl, химический элемент III группы периодической системы, атомный номер 81, атомная масса 204,383. Название от греч. thallos — зеленая ветка (по ярко-зеленой линии спектра). Большой энциклопедический словарь
