тиоуксусная кислота
ТИОУКСУСНАЯ КИСЛОТА CH3C(O)SH
мол. м. 76,12; желтая жидкость; т. шт. −17 °C, т. кип. 93 °C; 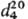 1,068;
1,068; 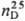 1,4630; рKа 3,33 (вода, 25 °C); раств. в этаноле, диэтило-вом эфире; медленно разлагается водой с выделением H2S. Относительно стабильна, начинает разлагаться при температуре выше 120 °C; при нагр. с ZnCl2 диспропорционирует на уксусную и дитиоуксусную кислоты.
1,4630; рKа 3,33 (вода, 25 °C); раств. в этаноле, диэтило-вом эфире; медленно разлагается водой с выделением H2S. Относительно стабильна, начинает разлагаться при температуре выше 120 °C; при нагр. с ZnCl2 диспропорционирует на уксусную и дитиоуксусную кислоты.
Т.к. образует соли; нагревание Pb-соли до ~150 °C приводит к тиоангидриду (ацетилсульфиду) (CH3CO)2S, последний м. б. получен также обработкой ацетилхлорида K2S.
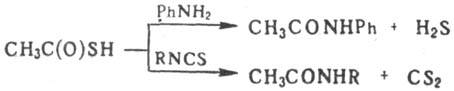
При взаимодействии Т.к. с альдегидами образуются ди(тиоацетаты) RCH(SCOCH3)2, с ароматич. аминами и изотиоцианатами — замещенные ацетамиды, напр.:
Т.к. вступает в реакции радикального присоединения к олефинам (против правила Марковникова) и алкинам; реакция используется в орг. синтезе, напр. при получении алкан-сульфокислот:
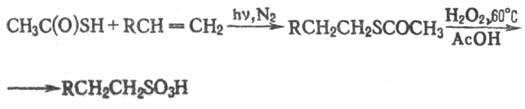
Т.к. существует в виде равновесной смеси тиол- и тион-уксусной кислот: CH3C(O)SH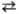 CH3C(S)OH с преобладанием тиольной формы. Сложные эфиры Т.к. известны 2 типов: S-эфиры CH3C(O)SR и О-эфиры CH3QS)OR; температуры кипения О-эфиров немного ниже, чем для соответствующих S-эфиров. Эфиры Т.к. не м. б. получены прямой этерификацией кислоты спиртами из-за образования смеси S-эфира и соответствующего ацетата (исключение — этерификация трифенилкарбинола с образованием S-эфира). S-Эфиры получают: присоединением Т.к. к олефинам; взаимод. солей Т.к. с ал-килгалогенидами (реакция 1); ацилированием тиолов ацетил-хлоридом (2); реакцией Т.к. с тиоцианатами с образованием дитиоуретанов и последующим отщеплением HSCN (3); взаимод. кетена с тиолами при −80 °C (4); разложением иминотиоэфиров (5):
CH3C(S)OH с преобладанием тиольной формы. Сложные эфиры Т.к. известны 2 типов: S-эфиры CH3C(O)SR и О-эфиры CH3QS)OR; температуры кипения О-эфиров немного ниже, чем для соответствующих S-эфиров. Эфиры Т.к. не м. б. получены прямой этерификацией кислоты спиртами из-за образования смеси S-эфира и соответствующего ацетата (исключение — этерификация трифенилкарбинола с образованием S-эфира). S-Эфиры получают: присоединением Т.к. к олефинам; взаимод. солей Т.к. с ал-килгалогенидами (реакция 1); ацилированием тиолов ацетил-хлоридом (2); реакцией Т.к. с тиоцианатами с образованием дитиоуретанов и последующим отщеплением HSCN (3); взаимод. кетена с тиолами при −80 °C (4); разложением иминотиоэфиров (5):
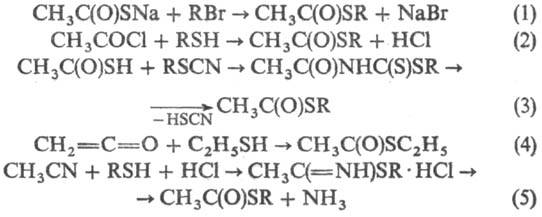
О-Эфиры получают действием H2S на иминоэфиры или взаимод. хлортиоформиатов с реактивами Гриньяра:
CH3C(=NH)OR + H2S → CH3C(S)OR + NH3 ClC(S)OC2H5 + CH3MgI → CH3C(S)OC2H5 + MgICl
Наиб. удобный способ получения Т. к. — обработка уксусного ангидрида H2S в присутствии небольшого количества твердой щелочи:
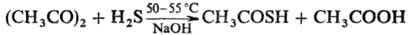
Т.к. получают также действием P2S5 на CH3COOH или реакцией CH3COCl с H2S.
Применяют Т.к. в качестве заменителя H2S в аналит. химии; Mg-соль Т. к. — антидот при отравлениях ртутью, S-этиловый эфир-ингибитор коррозии.
В орг. синтезе Т.к. используют для модификации α,β-не-насыщ. 3-кетостероидов, S-ацетилирования кофермента А и пантетина.
Т. воспл. 11 °C; обладает слезоточивым действием, токсична, ЛД50 0,125 мг/кг (мыши, перорально).
Лит.: Reid E. E., в сб.: Organic chemistry of bivalent sulfur, v. 4, N. Y., 1962, p. 11–37; Физер Л., Физер М., Реагенты для органического синтеза, пер. с англ., т. 3, М., 1970, с. 336–40.
А. А. Дудинов
Значения в других словарях
- Тиоуксусная кислота — См. Тиокислоты. Энциклопедический словарь Брокгауза и Ефрона
