тиофосфаты органические
ТИОФОСФАТЫ ОРГАНИЧЕСКИЕ
соед. общей формулы ХnY3-nР=2, где X = OR или SR, Y = OH или SH, Z = О или S, R-орг. радикал, n=1-3 (молекула содержит не менее одного атома S, связанного с атомом Р); Т.о. наз. также соли соответствующих кислот (при n < 3).
Подразделяют Т.о. на полные (третичные, или средние, n = 3) и кислые (первичные n = 1, вторичные n — 2). Название Т.о. включает назв. радикалов (через дефис приводят символ связанного с P гетероатома) и назв. тио- фосфатного остатка, иногда Т.о. наз. как эфир тиокислоты фосфора [напр., CH3O(C4H9S)P(S)OH-О-метил-S-бутилдитиофосфат, или О-метиловый S-бутиловый эфир дитиофосфорной кислоты].
Полные Т.о. Соед. с низшими алифатич., смешанными алифатич. и ароматич. радикалами, как правило подвижные жидкости (реже — масла), остальные-кристаллич. вещества (см. табл.). Соед.. с относительно небольшой мол. массой перегоняются в вакууме; большинство полных Т.о. раств. в органических растворителях, низшие члены ряда ограниченно раств. в воде.
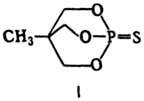
Конфигурация молекул эфиров-тетраэдрическая. Величины дипольных моментов находятся обычно в пределах 7,67∙10−30-1,07∙10−29 Кл∙м; исключение-некоторые би-циклотионфосфаты (напр., для соед. формулы I μ 2,235∙10−29 Кл∙м) и арилзамещенные тионфосфаты [напр., для C2H5O(n-O2NC6H4O)2PS μ 1,635∙10−29 Кл∙м].
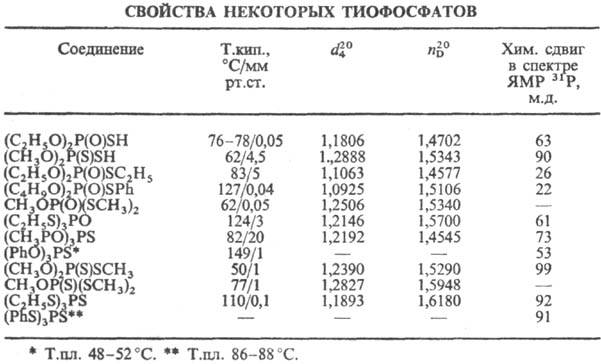
В ИК спектрах полоса поглощения связи P=S (низкой характеристичности) находится в области 650–700 см−1. В спектрах ЯМР31Р хим. сдвиги (м. д.) для соед. типа (RO)3PS- 50–85, для (RO)2P(S)SR-90–100, для (RO)2P(O)SR-13–40.
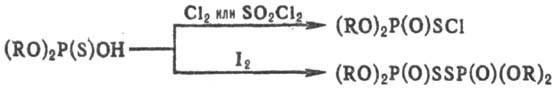
Полные Т.о. образуют комплексы с солями мн. металлов; комплексы тиофосфорильных соед. (содержат тиофосфо-рильную группу P=S) с солями тяжелых металлов менее стабильны, чем подобные комплексы полных фосфатов. Тиофосфорильные соед. сравнительно легко (напр., при действии Na) восстанавливаются до полных эфиров кислот трехвалентного Р; при действии H2O2, HNO3 или др. окислителей (иногда H2O) превращ. в фосфорильные соед. (содержат фосфорильную группу Р=О); при действии Cl2 или SO2Cl2 — в фосфорилсульфенхлориды (RO)3P(O)SCl.
Соед. типа (RO)3P(S)OR' (тионфосфаты) склонны к изомеризации в тиолфосфаты (RO)3P(O)SR' (см. Пищимуки реакция). Продукты S-алкилирования образуются также при действии R'Hal на тиофосфорильные соед., напр.:
(RO)3P(S) + R'Hal : (RO)2P(O)SR' + RHal
По эфирному атому S реагируют некоторые электрофилы, напр.:
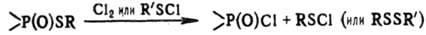
Полные Т.о. с низшими алифатич. радикалами алки-лируют NR3, R2S, (NH2)2C(S) и некоторые др. орг. основания; при этом тионфосфаты, содержащие хотя бы одну группу RO, претерпевают тион-тиольную перегруппировку, напр.:
(CH3O)3PS + (CH3)2NR → [(CH3O) (CH3S)P(O)O]−[(CH3)3NR]+ (CH3O)2P(S)SCH3 + (CH3)2S → [(CH3S)2Р(O)О]− [(CH3)3S]+
Соед. сравнительно устойчивы к гидролизу в нейтральных средах и, как правило, быстро разлагаются (с выделением H2S) в кислых средах. В щелочных средах гидролиз чаще всего приводит к образовадию солей кислых Т.о. При гидролизе и алкоголизе полных Т.о., содержащих одновременно группы RO и RS, обычно в первую очередь отщепляется группа RS. В остальном полные Т.о. близки по своим свойствам к полным фосфатам (см. фосфаты органические).
Обычно полные Т.о. получают взаимод. POCl3 или PSCl3 со спиртами, фенолами и тиолами (или их Na-производны-ми) в присутствии орг. оснований. Соед. с тиофосфорильной группой можно также получать присоединением S к тио-фосфитам (RO)nP(SR)3-n или нагреванием триорганилфосфатов с P2Sc (в случае алкилфосфатов возможно образование S-алкилфосфатов в результате тион-тиольной перегруппировки).
Полные Т.о. с разнообразными S-алкильными радикалами м. б. получены присоединением фосфорилсульфенхлоридов, а также кислых Т.о. к соед. с кратными связями, напр.:
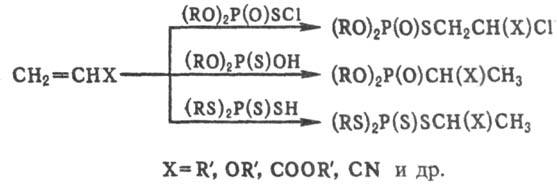
Т.о. типа (RO)2P(O)SR' в лаб. условиях часто получают взаимод. вторичных или третичных фосфитов с RSX (X = С1, CN, R2N, SR). Общий метод синтеза тетратиофосфатов основан на взаимод. P2S5 с тиолами, простыми эфирами, полными боратами, алкоксисиланами или спиртами.
Кислые Т.о. Наиб. полно изучены вторичные тио- и ди-тиофосфаты (RO)2P(S)OH и (RO)2P(S)SH. Остальные типы вторичных тиофосфатов, обладающие сравнительно низкой устойчивостью, в индивидуальном состоянии не охарактеризованы (достаточно подробно изучены только их соли). Еще меньшей устойчивостью обладают первичные тиофосфаты [напр., дитиофосфаты типа RSP(S)(OH)2 разлагаются уже на холоду, а их соли — при нормальных условиях]; охарактеризованы и используются в синтезах только соли первичных тиофосфатов с анионами ROP(O)(OH)S− и RSP(O)(OH)O−.
Вторичные тиофосфаты с R = Alk обычно жидкости, перегоняющиеся в вакууме; остальные-кристаллич. вещества; раств. в органических растворителях, низшие — в воде. Монотиофосфаты (RO)2P(S)OH в водных растворах существуют преим. в тиольной форме; в чистом виде и спиртовых растворах — в тионной. В анионах солей [(RO)2P(O)S]−M+ (М = NH4, NR3H, Na, К) отри-цат. заряд распределен между атомами S, P и фосфо-рильным атомом О.
Вторичные тиофосфаты-кислоты средней силы; напр., рKа в водном этаноле (7 и 80%-ный C2H5OH) для (CH3O)2P(S)OH соотв. 1,18 и 2,5; для (изо-C3H7О)2Р(S)ОН-1,59 и 2,9; для (изо-C3H7O)2P(S)SH-l,82 и 2,65; для (C4H9O)2P(S)SH-1,83 и 2,64.
В ИК спектрах полосы поглощения связи P=S 600–660 см−1, связи Р—SH (в CCl4) ок. 2540 см−1. В спектрах ЯМР 31Р хим. сдвиги (м. д.) для соед. типа (RO)2P(S)OH-45–71, для (RO)2P(S)SH-80–90 м. д.
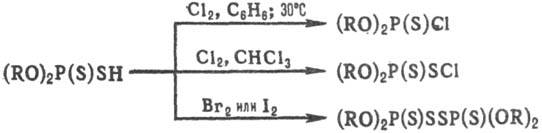
Кислые Т.о. образуют соли с NH3 и аминами, с гидроксидами и оксидами металлов. При действии На12 (Cl, Br, I) вторичные тиофосфаты в зависимости от условий образуют след. соединения:
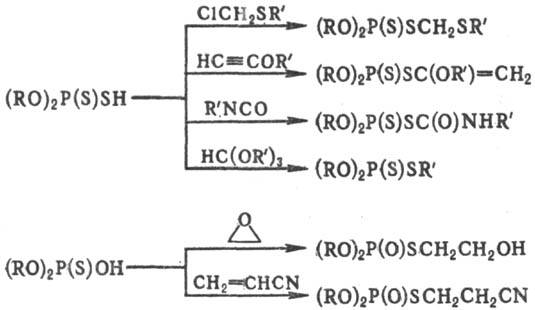
Алкилированные по атому S продукты образуются при действии на О,О-диалкилтиофосфаты RHal, соед. с кратными связями, триалкиловых эфиров ортомуравьиной кислоты, эпоксидов и др., напр.:
О,О-Диорганилтиофосфаты обычно получают присоединением S к диорганилфосфитам. Эти соед. с хорошим выходом образуются также при гидролизе хлорангидридов эфиров тиофосфорных кислот (RO)2P(S)C1 и путем ацидолиза полных тионфосфатов (RO)3P(S). Наиб. используемый в промышленности метод синтеза О,О-диорганилдитиофосфатов основан на реакции спиртов или фенолов с P2S5. Высшие О,О-диалкилдитиофосфаты и олигомеры на их основе получают путем переэтерификации:
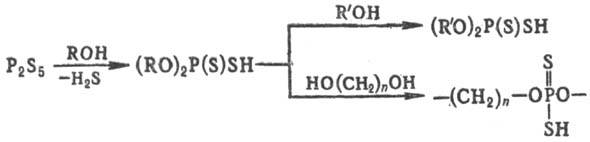
В лабораторных условиях О,О-диалкилдитиофосфаты получают также алкоголизом органилтритиометафосфатов RSPS2.
Среди полных Т.о. встречаются соед. с относительно высокой токсичностью для теплокровных. Так, для О,О-ди-этил-S-(2-диэтиламино)этилтиофосфата (амитон, или те-трам) и его иодэтилата ЛД50 (мыши, внутрибрюшинно) соотв. 0,5 и 0,17 мг/кг.
Представители полных Т.о. составляют наиб. многочисл. группу фосфорорг. пестицидов; Т.о. используют также в качестве противоизносных и антикоррозионных присадок к смазочным маслам, пластификаторов полимерных материалов, флотац. агентов и дефолиантов.
Лит.: Нифантьев Э. Е., Химия фосфорорганических соединений, М., 1971, с. 171–97; Fest С., Schmidt K.-J., The Chemistry of organophosphorus pesticides, В., 1973; Ailman D., Mages R, в кн.: Organic phosphorus compounds, v. 7, N.Y., 1976, p. 487–865.
Г. И. Дрозд
