титана сульфаты
ТИТАНА СУЛЬФАТЫ
Сульфат титана(II) TiSO4 известен в виде неустойчивых водных растворов, получаемых растворением TiO, Ti или Ti(OH)2 в H2SO4 при пропускании H2; сильный восстановитель; используют при получении орг. красителей.
Сульфат титана(III) Ti2(SO4)3-зеленые кристаллы тетрагон. сингонии (а = 0,844 нм, с = 2,195 нм); плотн. 2,78 г/см3; выше 300 °C разлагается до TiO2; на воздухе окисляется; не раств. в воде, этаноле, диэтиловом эфире, конц. H2SO4; получают в виде водных растворов восстановлением растворов сульфатов Ti(IV) при электролизе, действии Zn, Fe и т. п. или растворением Ti в H2SO4. Из растворов можно получить гидраты с 8 (синие) и 5 (фиолетовые) молекулами воды. Из растворов в H2SO4 кристаллизуются кислые сульфаты TiH(SO4)2∙4H2O (фиолетовый) и Ti2H4(SO4)5 ∙ 3H2O (голубой).
Сульфат титана (IV) Ti(SO4)2 — бесцветные кристаллы с шелковистым блеском; 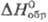 −2180 кДж/моль; выше 150 °C разлагается; очень гигроскопичен, гидролизуется водой; разлагается при действии этанола, диэтилового эфира, ацетона. Оксосульфат TiOSO4 (сульфат титанила) — бесцв. с желтоватым оттенком кристаллы ромбич. сингонии (а = 0,6340 нм, Ъ — 1,0936 нм, с = 0,5150 нм, z = 4, пространственная группа Pmn21);
−2180 кДж/моль; выше 150 °C разлагается; очень гигроскопичен, гидролизуется водой; разлагается при действии этанола, диэтилового эфира, ацетона. Оксосульфат TiOSO4 (сульфат титанила) — бесцв. с желтоватым оттенком кристаллы ромбич. сингонии (а = 0,6340 нм, Ъ — 1,0936 нм, с = 0,5150 нм, z = 4, пространственная группа Pmn21); 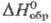 —1875 кДж/моль; выше ~350 °C разлагается с выделением SO3; устойчив на воздухе, плохо раств. в воде и разб. кислотах, разлагается растворами щелочей и NH3. Моногидрат TiOSO4-H2O — бесцветные кристаллы ром-бич. сингонии (а = 0,9788 нм, b = 0,5120 нм, с = 0,6598 нм, z = 4, пространственная группа P212121); устойчив на воздухе, медленно раств. в холодной воде; обезвоживается при ~330 °C. Дигидрат TiOSO4∙2H2O — бесцветные кристаллы; медленно раств. в воде (54,2% по массе при 20 °C); конц. растворы при комнатной температуре устойчивы, не гидролизуются; обезвоживается ок. ~300 °C. Оксосульфат Ti и его гидраты кристаллизуются из конц. растворов в H2SO4 выше 100 °C.
—1875 кДж/моль; выше ~350 °C разлагается с выделением SO3; устойчив на воздухе, плохо раств. в воде и разб. кислотах, разлагается растворами щелочей и NH3. Моногидрат TiOSO4-H2O — бесцветные кристаллы ром-бич. сингонии (а = 0,9788 нм, b = 0,5120 нм, с = 0,6598 нм, z = 4, пространственная группа P212121); устойчив на воздухе, медленно раств. в холодной воде; обезвоживается при ~330 °C. Дигидрат TiOSO4∙2H2O — бесцветные кристаллы; медленно раств. в воде (54,2% по массе при 20 °C); конц. растворы при комнатной температуре устойчивы, не гидролизуются; обезвоживается ок. ~300 °C. Оксосульфат Ti и его гидраты кристаллизуются из конц. растворов в H2SO4 выше 100 °C.
При упаривании сульфатных растворов Ti(IV) в большинстве случаев образуются стеклообразные массы. Кипячение даже сильнокислых растворов приводит к практически полному выделению TiO2∙nH2O. Из растворов с большой концентрацией H2SO4 кристаллизуются титансерные кислоты (кислые Т.е.) TiOSO4∙H2SO4∙H2O и TiOSO4∙H2SO4∙2H2O. Они хорошо раств. в воде, разлагаются этанолом, диэтиловым эфиром и т. п. Растворы сульфатов Ti(lV) получают взаимод. TiO2 ∙ nH2O и др. соед. Ti с H2SO4. Это промежут. продукты при получении пигментного TiO2 сернокислотным способом, компоненты дубителей для кож. ПДК в воде 0,1 мг/л (в пересчете на Ti).
Лит.: Годнева М. М., Мотов Д. Л., Химия подгруппы титана. Сульфаты и их растворы, Л., 1980.
Я. И. Федоров
