трансаннулярные реакции
ТРАНСАННУЛЯРНЫЕ РЕАКЦИИ (от лат. trans — через, за пределами и annulus — колечко)
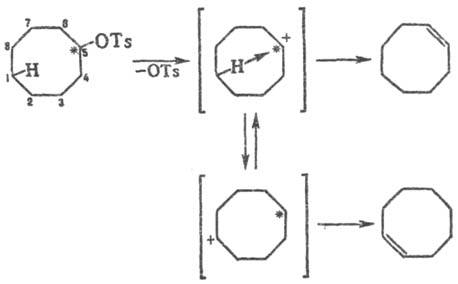
осуществляются между несвязанными между собой атомами средних циклов (C8-C11), находящимися на противоположных сторонах кольца, но сближенными в пространстве. Обусловлены характерными для средних циклов конформациями, в которых некоторые связи углеродных атомов направлены внутрь кольца (интрааннулярные связи). Т. р. сопровождаются перескоком пространственно сближенного атома H к положительно заряженному атому С (гидридный переход). Такой переход проявляется, напр., при сольволизе и дегидратации меченого 14С-циклооктанолтозилата, когда меченый атом оказывается в положениях 5, 6 или 7 (Ts = n-CH3C6H4SO2). При этом двойная связь возникает не только у того атома С, где был заместитель, но и на противоположной стороне цикла:
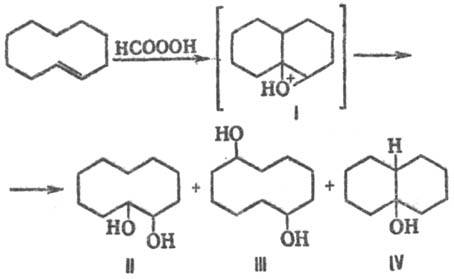
Т. р. наблюдаются также при окислении среднециклич. олефинов, напр. транс-циклодецена надмуравьиной кислотой; в результате гидридного перехода интрааннулярных атомов H к карбкатионному центру в промежуточном катионе I кроме "нормального" продукта II образуются трансанну-лярные продукты III и IV:
'
Другой тип Т. р. — циклизация циклополиенов (интрамол. диеновый синтез). Так, циклооктатриен и его аналоги находятся в таутомерном равновесии с соответствующим бициклич. соединением.
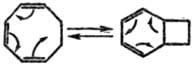
Это редкий вид таутомерии, при которой происходит лишь перераспределение электронной плотности без переноса к.-л. атомов.
Т. р. стереоспецифичны: если в качестве исходного вещества взят определенный пространств. изомер, то продуктом реакции, как правило, будет также изомер определенного пространств. строения.
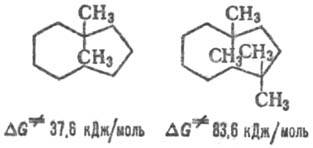
В "ряде среднециклич. соед. между группами, противостоящими друг другу, отмечены трансаннулярные взаимодействия (Т. в.), способные значительно понижать конформац. подвижность циклоалканов в осн. благодаря затруднениям, создаваемым для псевдовращений молекулы. Например, величины инверсионных барьеров (ΔG∙) для 1,1-диметил-циклононана на 12,5 кДж/моль больше, чем для незамещ. циклононана, а для 1,1,4,4-тетраметилпроизводного, в молекуле которого взаимодействующие группы CH3 расположены напротив друг друга, ΔG∙ возрастает более чем в 3 раза:
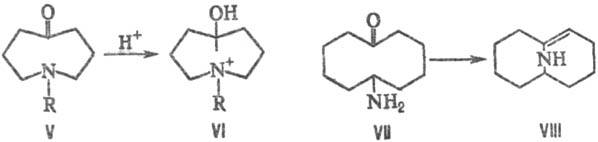
Т. в. объясняется образование соед. VI при попытке получения аммониевой соли из аминокетона V, при этом протон атакует не атом азота, а карбонильную группу; в результате образования мостика между двумя кольцами уменьшается энергия напряжения молекулы. Подобным образом амин VII легко превращается в бициклич. енамин VIII:
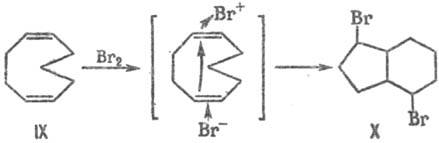
При электроф. присоединении брома к (1Z, 5Z)-циклоно-надиену IX благодаря трансаннулярному участию пространственно сближенной второй двойной связи образуется аддукт X.
Для некоторых циклич. аминокетонов, содержащих ацило-иновую группировку, Т. в. карбонильной и аминогрупп проявляется в понижении основности амина и смещении частоты группы CO в ИК спектре. Проявления Т. в. обнаруживаются также в соед. циклогексанового (взаимод. заместителей в положениях 1 и 4), гетероциклич. рядов и др.
Г. В. Гришина
