триазолы
ТРИАЗОЛЫ
мол. м. 69,6. Различают 1,2,3-Т. (озотриазол), или вицинальный (формула I), и 1,2,4-Т. (пирродиазол), или симметричный (II). Незамещенные и С-замещенные Т. могут существовать в двух таутомерных формах: для 1,2,3-Т.-1H- и 2H-формы (Ia и Iб соотв.), для 1,2,4-Т.-1H- и 4H-формы (IIа и IIб соотв.):

Т. и их алкил- или арилпроизводные — бесцветные кристаллы или высококипящие жидкости (см. табл.). Хорошо раств. в большинстве орг. растворителей, незамещенные Т. раств. в воде; проявляют кислотные и слабые основные свойства. Устойчивы к нагреванию, действию кислот, оснований, некоторых окислителей (KMnO4, H2O2) и восстановителей (Zn в CH3COOH, Na в NH3, LiAlH4). С AgNO3 образуют нерастворимые в воде соли; 1,2,4-Т. дает стабильные гидрохлорид (т. пл. 169 °C) и гексахлорплатинат (т. пл 73–75 °C). Производные 1,2,4-Т. образуют комплексы с солями некоторых металлов (Hg, Ag, Pb, Zn).
Т. — 6π-электронные ароматич. системы. Электроф. замещение в Т. идет по атомам N или С. Наиб. характерны реакции алкилирования и ацилирования. 1,2,3-Т. и 1-замещенный 1H -1,2,3-Т. алкилируются алкилгалогенидами, диметилсульфатом, диазометаном, а также вступают в реакцию Манниха. 1,2,3-Т. избирательно метилируется по положению 1 действием CH3I на его Ag- или Tl-соли или при реакции в щелочной среде; взаимод. с CH2N2 идет преим. по положению 2. 1-Метилзамещенный 1,2,3-Т. легко метилируется далее с образованием 1,3-дизамещенной соли триазолия; 2-метилзамещенный образует соль 1,2-диметил-1,2,3-триа-золия лишь под действием сильных метилирующих агентов, напр.:
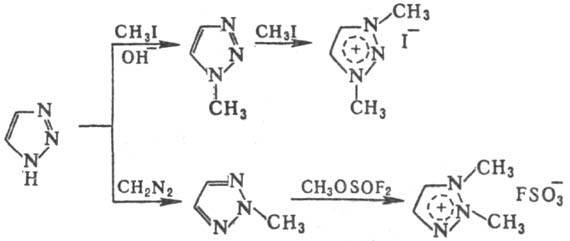
Алкилирование диметилсульфатом замещенных 1,2,3-Т. приводит к смеси 1H- и 2H-производных.
Алкилирование 1,2,4-Т. в щелочной среде идет до 1-алкил-производных с дальнейшим образованием четвертичных солей по атому N-4. 4-Замещенные 4H-1,2,4-Т. кватерни-зуются по атомам N-1 или N-2.
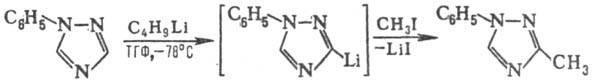
Для N-замещенных 1,2,4-Т. под действием C4H9Li и CH3I протекает реакция С-метилирования, напр.:
Взаимод. 1H-1,2,3- или 4H-1,2,4-Т. с галогенангидридами или ангидридами кислот в безводных растворителях при повышенных температурах приводит к соответствующим N- или С-ацилпро-изводным.
По отношению к электроф. агентам, генерируемым в сильнокислой среде, Т. инертны, т. к. при этом превращ. в неактивные триазолиевые катионы. Нитрование замещенных 1,2,4-Т. затрагивает преим. заместитель; напр., 4-метил-2-фенил-2H-1,2,3-Т. нитруется в n-положение ароматич. ядра. Нитрование 1,2,4-Т. в цикл происходит только при наличии в молекуле электронодонорного заместителя; напр., действие дымящей HNO3 на 3-гидрокси-1,2,4-Т. приводит к 3-гидрокси-5-нитро- 1,2,4-Т. Незамещенный 1,2,3-Т. бромируется Br2 до 4,5-дибромпроизводного, но не хлорируется Cl2 в воде, водном растворе CH3COONa или в присутствии РеCl3. Хлорирование 1-метил- и 4-метил-1H-1,2,3-Т. в CCl4 или в CHCl3 приводит соотв. к 1-метил-4-хлор- и 4-метил-5-хлор-1H-1,2,3-Т.
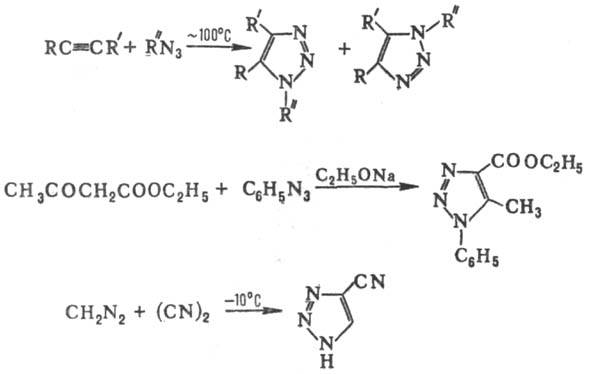
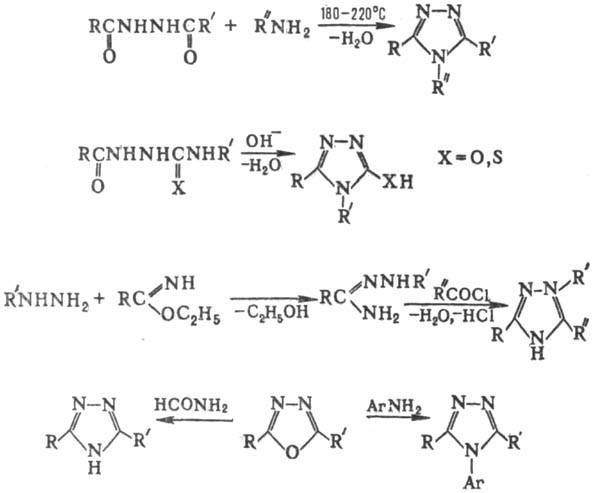
1,2,3-Т. и его производные получают взаимод. азидов с ацетиленами, ацетиленидами металлов или реактивами Гриньяра, с соед., содержащими активир. метиленовые группы, а также реакцией диазаалканов с активир. нитрилами — дицианом, галогенцианидами, эфирами циановой кислоты, напр.:
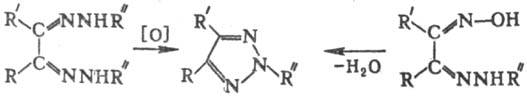
Общий метод получения 2-замещенных 2H-1,2,3-Т. — окисление бисарилгидразонов 1,2-дикарбонильных соед. под действием разл. окислителей [MnO2, HgO, соли Cu (II), K2Cr2O7] или внутримол. дегидратация арилгидразонокси-мов 1,2-дикарбонильных соед. под действием (CH3СО)2O или PCl5 в CHCl3:
1,2,4-Т. и его производные синтезируют из производных гидразина конденсац. методами или из др. гетероциклов, напр.:
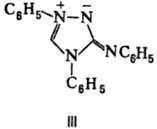
Производные 1,2,3- и 1,2,4-Т. — оптич. отбеливатели, стабилизаторы фотографич. эмульсий, полупродукты при получении пластификаторов, клеевых композиций и ингибиторов коррозии (напр., гуаназол-3,5-диамино-1,2,4-Т.), гербициды (напр., амизол — 3-амино- 1,2,4-Т.), катализаторы в пептидном синтезе; многие Т. биологически активны, обладают противобактериальной, нейролептич., гипотензивной, спаз-молитич. и др. активностью, стимулируют сердечную деятельность. Мезоионное соед. — нитрон (формула III; т. пл. 189–190 °C)-реагент для определения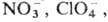 пикрат-ионов и др. анионов.
пикрат-ионов и др. анионов.
Лит.: Гетероциклические соединения, под ред. Р. Эльдерфилда, пер. с англ., т. 7, М., 1965; Китаев Ю.П., Бузыкин Б. И., Гидразоньт, М., 1974; Общая органическая химия, пер. с англ., т. 8, М., 1985, с. 429; Schofield К., Grim-mett M.R., Keene В. R. Т., Heteroaromatic nitrogen compounds: the azoles, Camb., 1976; Gilchrist T. L., Gymer G. E., "Adv. Heterocycl. Chem.", 1974, v. 16, p. 33–85.
Р. А. Караханов, В. И. Келарев
Значения в других словарях
- Триазолы — См. Пирроазолы. Энциклопедический словарь Брокгауза и Ефрона
