тулий
ТУЛИЙ (от греч. Thule — Туле, у античных географов — край-ний северный предел мира; лат. Thulium) Tm
хим. элемент III гр. периодической системы; относится к редкоземельным элементам (иттриевая подгруппа лантаноидов), ат. н. 69, ат. м. 168,9342. В природе один стабильный нуклид 169Tm. Конфи-гурация внеш. электронных оболочек атома 4f135s25p66s2; сте-пени окисления +3, +2, реже +4; энергии ионизации при по-следоват. переходе от Tm0 к Tm5+ соотв. 6,181, 12,05, 23,68, 42,69, 65,4 эВ; электроотрицательность по Полингу 1,0–1,2; атомный радиус 0,174 нм, ионные радиусы Tm3+ (в скобках указаны координац. числа) 0,102 нм (6), 0,113 нм (8), 0,119 нм (9), Tm2+ 0,117 нм (6), 0,123 нм (7).
Содержание в земной коре 2,7∙10−5% по массе, в морской воде 1∙10−7 мг/л. Вместе с др. РЗЭ содержится в ксенотиме, эвксените, монаците, бастнезите, лопарите, ортите и некоторых др. минералах.
Свойства. Т. — серебристо-белый металл, кристаллич. ре-шетка гексагон. типа Mg, а=0,35375 нм, с = 0,55546 нм, z=2, пространственная группа P63/mmc; т. пл. 1545 °C, т. кип. 1947 °C; плотн. 9,318 г/см3; C0p 27,0 Дж/(моль∙К); 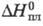 16,9 кДж/моль,
16,9 кДж/моль, 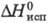 191 кДж/моль,
191 кДж/моль, 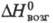 232 кДж/моль;
232 кДж/моль; 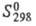 74,0 Дж/(моль∙К); давление пара 9,66 кПа (1545 °C); температурный коэф. линейного расширения 5,8∙10−6K−1 (300 К); ρ 9∙10−7 Ом∙м; антиферромагнетик ниже 58 К (точ-ка Нееля); твердость по Бринеллю 471 МПа. Легко поддается мех. обработке.
74,0 Дж/(моль∙К); давление пара 9,66 кПа (1545 °C); температурный коэф. линейного расширения 5,8∙10−6K−1 (300 К); ρ 9∙10−7 Ом∙м; антиферромагнетик ниже 58 К (точ-ка Нееля); твердость по Бринеллю 471 МПа. Легко поддается мех. обработке.
На воздухе компактный T. практически не окисляется, при нагр. во влажном воздухе слабо окисляется. С минер. кислотами реагирует, давая Tm3+. Взаимод. с галогенами, халькогенами и N2 при нагревании. В водных средах находится в виде производных Tm(III). Существуют разл. комплексные соед. Tm(III) с орг. и неорг. лигандами. В присяг, сильных восстановителей (щелочные металлы) Tm3+ м. б. переведен в Tm2+; таким образом, напр., были получены TmX2, где X = Cl, Br, I. Соед. Tm(II) легко гидролизуются водой, окисляются O2 воздуха и водой. В халькогенидных системах T. существует в виде Tm(III) и Тт(II).
Сесквиоксид Tm2O3 — бесцв. с зеленоватым оттенком кристаллы; существуют в двух модификациях: кубической (а = 0,104866 нм, пространственная группа laЗ, z= 16) и моноклинной (а =1,381 нм, b = 0,3447 нм, с = 0,8505 нм, β = 100,20°, z = 6, пространственная группа С2m), которая образуется при нагр. кубич. формы ок. 1000 °C и давлении 4 МПа; т. пл. 2370 °C; C0p 116,7 Дж/(моль∙К); 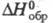 −1888,7 кДж/моль,
−1888,7 кДж/моль, 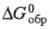 −1794,5 кДж/моль;
−1794,5 кДж/моль; 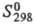 139,6 Дж/(моль∙К); получают при нагр. нитратов, сульфатов, оксалатов и др. соединений T. на воздухе выше 800–900 °C; входит в состав разл. оксидных материалов, в т. ч. стекол, керамик (напр., со свойствами высокотемпературных сверхпроводников).
139,6 Дж/(моль∙К); получают при нагр. нитратов, сульфатов, оксалатов и др. соединений T. на воздухе выше 800–900 °C; входит в состав разл. оксидных материалов, в т. ч. стекол, керамик (напр., со свойствами высокотемпературных сверхпроводников).
Трифторид TmF3- бесцветные кристаллы, плавленый — бледно-зеленого цвета; существует в двух модификациях: ромбической типа Fe3C (а = 0,6283нм , b = 0,6811 нм, с = 0,4408 нм, z = 4, пространственная группа Рпта, плотн. 7,95 г/см3) и выше 1050 °C — гексагональной типа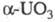 (а_ = 0,4059 нм, с = 0,4175 нм, z=1, пространственная группа C3m1, плотн. 6,30 г/см3); т. пл. 1158 °C; ΔH0пл 28,9 кДж/моль,
(а_ = 0,4059 нм, с = 0,4175 нм, z=1, пространственная группа C3m1, плотн. 6,30 г/см3); т. пл. 1158 °C; ΔH0пл 28,9 кДж/моль, 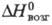 425 кДж/моль,
425 кДж/моль, 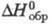 −1695 кДж/моль; получают из растворов солей Тm(Ш) осаждением фтористоводородной кислотой, взаимод. Tm2O3 с F2 при нагр.; применяют для металлотермич. получения металлического T.
−1695 кДж/моль; получают из растворов солей Тm(Ш) осаждением фтористоводородной кислотой, взаимод. Tm2O3 с F2 при нагр.; применяют для металлотермич. получения металлического T.
Трихлорид TmCl3 — бледно-желтые кристаллы с моноклинной решеткой типа AlCl3 (а =0,675 нм, b=1,173 нм, с = 0,639 нм, β =110,6°, z = 4, пространственная группа С2/m); T. пл. 828 °C, T. кип. 1487 °C; давление пара 20,7 Па (828 °C); 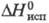 187 кДж/моль,
187 кДж/моль, 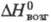 280 кДж/моль; образует гидраты; получают взаимод. смеси Cl2 и CCl4 с оксалатом T. при нагр. выше 200 °C либо хлорированием Т.; используют для получения металлического T. и его соединений.
280 кДж/моль; образует гидраты; получают взаимод. смеси Cl2 и CCl4 с оксалатом T. при нагр. выше 200 °C либо хлорированием Т.; используют для получения металлического T. и его соединений.
Получение. При переработке концентратов РЗЭ T. концентрируется с наиб. тяжелыми элементами — Yb и Lu. Разделение и очистку осуществляют экстракц. методом или ионообменной хроматографией с использованием комплексонов.
Металлический T. получают термич. восстановлением TmF3 кальцием или Tm2O3 лантаном.
T. выпускают в небольших масштабах и в виде Tm2O3 используют как активатор люминофоров для мед. радиографии (LaOBr — Tm, голубое свечение) и лазерных материалов (Er2O3 — Tm, CaWO4 — Tm), а также для изготовления синте-тич. фанатов. Искусств, радиоактивный нуклид 170Tm (Т1/2 128,6 сут) — источник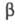 -излучения в портативных рентгеновских мед. установках.
-излучения в портативных рентгеновских мед. установках.
T. открыт в 1879 П. Клеве в виде оксида — тулиевой "земли".
Л. И. Мартыненко, С. Д. Моисеев, Ю. М. Киселев
Значения в других словарях
- Тулий — (лат. Thulium) Tm, химический элемент семейства лантаноидов (См. Лантаноиды); атомный номер 69, атомная масса 168,9342. Большая советская энциклопедия
- тулий — орф. тулий, -я Орфографический словарь Лопатина
- Тулий — (от греч. Thule — Tуле, y античных географов — крайний северный предел мира; лат. tulium * a. thulium; н. Thulium; ф. thulium; и. tulio), Tm, — хим. элемент III группы периодич. системы Mенделеева, ат.н. 69, ат. м. 168,9342, относится к лантаноидам. Горная энциклопедия
- Тулий — См. Гадолинитовые металлы и Периодическая законность химич. элементов. Энциклопедический словарь Брокгауза и Ефрона
- ТУЛИЙ — ТУЛИЙ (лат. Thulium) — Tm, химический элемент III группы периодической системы, атомный номер 69, атомная масса 168,9342, относится к лантаноидам. Название от греч. Thule — Туле. Металл. Плотность 9,318 г/см3, tпл 1545 °С. Большой энциклопедический словарь
- тулий — тулий м. Химический элемент, относящийся к лантаноидам; редкий металл, встречающийся в природе в соединениях. Толковый словарь Ефремовой
