фармакокинетика
ФАРМАКОКИНЕТИКА (от греч. pharmakon — лекарство и kinetikos — приводящий в движение)
изучает кинетич. закономерности процессов, происходящих с лек. средством в организме. Осн. фармакокинетич. процессы: всасывание, распределение, метаболизм и экскреция (выведение).
Основы Ф. создавались учеными разных специальностей в разл. странах. В 1913 нем. биохимики Л. Михаэлис и M. Ментен предложили уравнение кинетики ферментативных процессов, широко используемое в современной Ф. для описания метаболизма лекарственных средств (см. ферментативных реакций кинетика). Швед, физиолога Э. Видмарк, Д. Тандберг (1924) и T. Теорелл (1937) применяли системы дифференциальных уравнений при анализе разл. способов введения лекарственных средств. Амер. физиолог В. Гамильтон и другие (1931) использовали метод статистич. моментов для оценки параметров Ф. по эксперим. данным. Основы метаболизма лекарственных средств были заложены англ. биохимиками Х. Бреем, В. Торпом и К. Уайтом (1951). Практич. аспекты применения Ф. для оптимизации фармако-терапии разрабатывали К. Лапп во Франции (1948–56), А. ван Гемерт и др. в Дании (1950), Э. Крюгер-Тиммер (I960) и Ф. Дост (1953–68) в Германии (последний — автор термина "Ф.").
Развитие Ф. до нач. 50-х гг. 20 в. сдерживалось отсутствием высокочувствит. и селективных методов анализа микроконцентраций лек. веществ в биол. средах и недостаточной компьютеризацией исследований. С решением этих проблем Ф. получила дальнейшее развитие. В России развитие Ф. началось в 60-х гг. и связано с именами В. А. Филова, В. H. Соловьева и В. П. Яковлева.
Ф. содействует решению проблемы эффективности и безопасности фармакотерапии путем исследования зависимости терапевтич., токсич. и побочных эффектов лекарственных средств от их концентраций в месте действия или в анализируемой биол. среде (чаще всего в крови) и расчету оптим. режимов введения препаратов для создания и поддержания оптим. концентраций лек. веществ.
Для определения микроконцентраций лек. веществ и продуктов их метаболизма используют хроматографию, спектральные, иммунохим., радиоизотопные и др. методы.
Всасывание. Во всех случаях, когда лекарственное средство вводится не в сосудистое русло, оно попадает в кровь путем всасывания; в случае твердой формы сначала происходит растворение (высвобождение), а затем молекулы лек. вещества проникают в системный кровоток, чаще всего путем простой диффузии из места введения, а иногда с помощью активного транспорта. T. наз. пролонгированные (ретардированные) лек. формы обеспечивают медленное, контролируемое поступление лек. вещества в организм.
При приеме внутрь лек. вещества основного характера (амины) всасываются обычно в тонком кишечнике (сублингвальные лек. формы всасываются из ротовой полости, ректальные — из прямой кишки), лек. вещества нейтрального или кислого характера начинают всасываться уже в желудке.
Всасывание характеризуется скоростью и степенью всасывания (т. наз. биодоступностью). Степень всасывания — количество лек. вещества (в % или в долях), которое попадает в кровь при разл. способах введения. На всасывание сильно влияют лек. форма, а также др. факторы. При приеме внутрь многие лек. вещества в процессе всасывания под действием ферментов печени (или кислоты желудочного сока) биотранс формируются в метаболиты, в результате чего лишь часть лек. веществ достигает кровяного русла. Степень всасывания лек. вещества из желудочно-кишечного тракта, как правило, снижается при приеме лекарства после еды.
Влияние лек. форм на всасывание, пути и способы введения лекарственных средств изучает спец. раздел Ф. — "биофармация".
Распределение по органам и тканям. В организме лек. вещество распределяется между кровью, межклеточной жидкостью и клетками тканей. Распределение зависит от относит. сродства молекул лек. вещества к биомакромолекулам крови и тканей. Необходимое условие реализации фармакологич. действия лек. вещества — его проникновение в ткани-мишени; напротив, попадание лек. вещества в индифферентные ткани снижает действующую концентрацию и может привести к нежелат. побочным эффектам (напр., к канцерогенезу).
Для количеств, оценки распределения дозу лек. вещества делят на его начальную концентрацию в крови (плазме, сыворотке), экстраполированную к моменту введения, или используют метод статистич. моментов. Получают условную величину объема распределения (объем жидкости, в котором нужно растворить дозу, чтобы получить концентрацию, равную кажущейся начальной концентрации). Для некоторых водорастворимых лек. веществ величина объема распределения может принимать реальные значения, соответствующие объему крови, внеклеточной жидкости или всей водной фазы организма. Для жирорастворимых лекарственных средств эти оценки могут превышать на 1–2 порядка реальный объем организма благодаря избират. кумуляции лек. вещества жировыми и др. тканями.
Метаболизм. Лек. вещества выделяются из организма либо в неизмененном виде, либо в виде продуктов их биохим. превращений (метаболитов). При метаболизме наиб. распространены процессы окисления, восстановления, гидролиза, а также соединение (конъюгация) с остатками глюкуроновой, серной, уксусной кислот. Метаболиты, как правило, более поляр-ны и лучше растворимы в воде по сравнению с исходным лек. веществом, поэтому быстрее выводятся с мочой. Метаболизм может протекать спонтанно, но чаще всего катализируется ферментами (напр., цитохромами), локализованными в мембранах клеток и клеточных органелл печени, почек, легких, кожи, мозга и др.; некоторые ферменты локализованы в цитоплазме. Биол. значение метаболич. превращений — подготовка липорастворимых лекарственных средств к выведению из организма.
Экскреция. Лек. вещества выводятся из организма с мочой, калом, потом, слюной, молоком, с выдыхаемым воздухом. Выведение зависит от скорости доставки лек. вещества в выделит. орган с кровью и от активности собственно выделит. систем. Водорастворимые лек. вещества выводятся, как правило, через почки. Этот процесс определяется алгебраич. суммой трех осн. процессов: гломерулярной (клубочковой) фильтрации, канальцевой секреции и реабсорбции. Скорость фильтрации прямо пропорциональна концентрации своб. лек. вещества в плазме крови; канальцевая секреция реализуется насыщаемыми транспортными системами в нефроне и характерна для некоторых орг. анионов, катионов и амфотерных соед.; реабсорбции могут подвергаться нейтральные формы лек. веществ. Полярные лек. вещества с мол. м. более 300 выводятся преим. с желчью и далее с калом: скорость выведения прямо пропорциональна потоку желчи и отношению концентраций лек. вещества в крови и желчи. Остальные пути выделения менее интенсивны, но м. б. исследованы при изучении Ф. В частности, нередко анализируют содержание лек. вещества в слюне, поскольку концентрация в слюне для мн. препаратов пропорциональна их концентрации в крови, исследуют также концентрацию лек. веществ в грудном молоке, что важно для оценки безопасности грудного вскармливания.
Математические модели. Для обработки и интерпретации фармакокинетич. эксперимента используют разл. варианты мат. моделирования. В т. наз. компартментальной (частевой, камерной) модели организм представлен как совокупность взаимосвязанных абстрактных частей (камер), между которыми и внутри которых происходят процессы распределения, метаболизма и выведения лек. вещества. При условии, что скорости этих процессов пропорциональны концентрации (или количеству) лек. вещества в той части, где этот процесс происходит, изменение концентрации определяется уравнением:
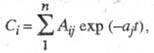
где n — число камер модели, Aij — предэкспоненциальные множители, aj — константа скорости, t — время.
Принципиальные недостатки такой модели — неопределенность понятия "часть", невозможность строгой идентификации числа частей и параметров, погрешности в статистич. оценках последних.
Для решения задач прикладной Ф. широко используют методы системного подхода и теории вероятности. В первом случае систему организм — лек. вещество рассматривают как целое ("черный ящик"). Для оценки параметров применяют принцип материального баланса, т. е. равенства между количествами поступившего и выведенного лек. вещества (после однократной дозы) или достижения равенства скоростей поступления и выведения лек. средства (при длит. введении):
F∙D=CL∙AUC; F∙R = CL∙Css
где D — доза, F- степень всасывания, AUC — площадь под кинетич. кривой изменения концентрации в крови (плазме, сыворотке) после однократного введения, R — скорость поступления лек. вещества в организм, Css — средняя стационарная концентрация при длит, введении, CL — клиренс, количество крови (в мл), которое очищается от лек. вещества в единицу времени. При внутрисосудистом введении F = 1. При внесосудистом введении степень всасывания (F) оценивается путем сравнения площадей под кинетич. кривыми, соответствующими разным путям введения лек. вещества.
Вероятностный подход рассматривает кинетич. кривые как кривые плотности распределения молекул лек. вещества по времени их пребывания в анализируемой среде. С помощью статистич. моментов рассчитывают т. наз. немодельные параметры (среднее время удерживания лек. вещества в организме, клиренс лек. вещества и объем его распределения).
Для решения задач фундам. Ф. используют модель физиол. (перфузионного) типа (впервые предложили К. Бичофф и P. Браун в 1966), где в качестве частей рассматриваются реальные органы и ткани, связанные артериальным и венозным кровоснабжением. Параметры модели — объемы органов, скорости кровотока через них, коэффициенты распределения лек. вещества между кровью и тканями, метаболич. и выделит. активность органов оцениваются экспериментально. Реализация модели осуществляется путем решения системы дифференциальных уравнений с известными параметрами. Физиол. модель используется при решении такой сложной и важной задачи, как межвидовой перенос данных Ф.
Влияние разл. факторов на Ф. На фармакокинетич. процессы влияют: свойства лек. формы и ее способность высвобождать активное начало, физ. и хим. свойства действующего вещества (величина молекулы, растворимость, липофильность, наличие полярных групп и активных центров и др.), объем органов и тканей, скорость потока крови через них, проницаемость капилляров и клеточных мембран, pH вне- и внутриклеточных сред, количество и активность метаболич. ферментов и компонентов активных транспортных систем, характеристики распределения между кровью и тканями, функцией, активность выделит, органов, а также возраст, патологич., генетич. факторы, климат, характер питания, биол. ритмы и т. д. К группам риска в Ф. относят больных пожилого и детского возраста, беременных и больных с заболеваниями выделит, органов.
Ф. наряду с фармакодинамикой (изучает действие лек. вещества на организм) позволяет выработать основы рациональной тактики лек. лечения.
Лит.: Соловьев В.H., Фирсов А.А., Филов В. А., Фармакокине-тика,М., 1980; Лакин К. M., Крылов Ю. Ф., Биотрансформация лекарственных веществ, М., 1981; Холодов Л.E., Яковлев В.П., Клиническая фармакокинетика. M., 1985; Wagner J. G., Fundamentals of clinical pharma-cokinetics, Hamilton, 1975.
Л. Е. Холодов, В. А. Горькое
Значения в других словарях
- фармакокинетика — орф. фармакокинетика, -и Орфографический словарь Лопатина
- Фармакокинетика — I Фармакокинетика (греч. pharmakon лекарство kinētikos относящийся к движению) раздел фармакологии, изучающий закономерности всасывания, распределения, метаболизма и выделения лекарственных средств. Медицинская энциклопедия
