фторобораты
ФТОРОБОРАТЫ
соли фтороборных кислот. Важнейшие из них — тетрафторобораты (T.) — производные тетра-фтороборной кислоты HBF4, известной в виде водных растворов, обладающих сильнокислой реакцией; их получают взаимод. фтористоводородной кислоты с H3BO3 или BF3. T. металлов синтезируют действием HBF4 на металлы, оксиды или карбонаты металлов, а также взаимод. BF3 с фторидами металлов, H3BO3 — с гидрофторидами металлов и т. п.
Т. — кристаллы, обычно изоморфные с перхлоратами. При натр, диссоциируют с отщеплением BF3. T. щелочных и мн. тяжелых металлов раств. в воде. Свежеприготовленные водные растворы T. щелочных металлов имеют нейтральную реакцию. В этих растворах происходит медленный гидролиз с образованием в первую очередь ионов гидроксифторобората [BF3OH]−. Только в очень разб. растворах наблюдается дальнейший гидролиз с образованием ионов [BF2(OH)2]−.
T. щелочных металлов, NH4+ и Tl(I) кристаллизуются из водных растворов в безводном состоянии (только для LiBF4 известны моно- и тригидраты). T. магния и мн. двухвалентных металлов (Fe, Cu, Со, Ni, Mn, Zn, Pb и др.) образуют гексагидраты, Ag — моногидрат. В их молекулах вода входит во внутр. сферу катиона, напр. [Cd(H2O)6]BF4. Гидраты T. тяжелых металлов нестойки и при натр. разлагаются с выделением паров воды и BF3. Более устойчивы соед. MF2∙BF3, образующиеся при действии паров BF3 на фториды металлов. Предполагают, что их строение [MF]BF4.
T. многих металлов легко образуют аммиакаты, напр. [Ni(NH3)6](BF4)2, [Ag(NH3)2]BF4. Эти соед. при натр, разлагаются с образованием гл. обр. фторида металла и BF3∙NH3; аммиакаты T. кадмия, Ni, Со(III), Cr(III) мало раств. в воде. Описаны многочисленные амминокомплексы T. с орг. основаниями.
Известны T. азотсодержащих оснований — нитрозила NOBF4, нитрозония NO2BF4, гидразония N2H5BF4, малоустойчивых сложных катионов — Cl2OBF4, NSBF4, IOBF4 и др. В большинстве они разрушаются при действии воды.
Существует большое число T. орг. оснований, напр. [(C4H9)4N]BF4, C6H5N2BF4, (C6H5)3CHBF4, оксониевых соед., напр. (C2H5)3OBF4.
T. калия KBF4 — бесцветные кристаллы с ромбич. решеткой (а = 0,785 нм, b = 0,568 нм, с = 0,737 нм, z = 4, пространственная группа Рпта); при 283 °C переходит в кубич. модификацию (а = 0,726 нм),  перехода 13,8 кДж/моль; т. пл. 570 °C, т. разл. 930 °C; плотн. 2,55 г/см3;
перехода 13,8 кДж/моль; т. пл. 570 °C, т. разл. 930 °C; плотн. 2,55 г/см3; 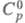 115 Дж/(моль∙К);
115 Дж/(моль∙К); 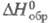 −1884 кДж/моль,
−1884 кДж/моль, 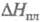 18,0 кДж/моль;
18,0 кДж/моль; 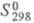 130 Дж/(моль∙К); плохо раств. в воде (0,44% по массе при 20 °C, 6,27% при 100 °C), этаноле, диэтиловом эфире.
130 Дж/(моль∙К); плохо раств. в воде (0,44% по массе при 20 °C, 6,27% при 100 °C), этаноле, диэтиловом эфире.
T. натрия NaBF4 — бесцветные кристаллы с ромбич. решеткой (а — 0,625 нм, b = 0,677 нм, с = 0,682 нм, z = 4, пространственная группа Cmcm); при 243 °C переходит в моноклинную (по др. данным, в кубическую) модификацию,  перехода 6,7 кДж/моль; т. пл. 406 °C (с частичным разл.); плотн. 2,47 г/см3;
перехода 6,7 кДж/моль; т. пл. 406 °C (с частичным разл.); плотн. 2,47 г/см3; 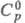 120,2 Дж/(моль∙К);
120,2 Дж/(моль∙К); 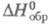 −1845 кДж/моль,
−1845 кДж/моль, 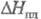 13,6 кДж/моль;
13,6 кДж/моль; 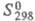 145,3 Дж/(моль∙К); раств. в воде (50,7% по массе при 25 °C), плохо — в этаноле (0,47% при 25 °C), метаноле (4,17% при 25 °C), ацетоне (~ 1%), не раств. в диэтиловом эфире.
145,3 Дж/(моль∙К); раств. в воде (50,7% по массе при 25 °C), плохо — в этаноле (0,47% при 25 °C), метаноле (4,17% при 25 °C), ацетоне (~ 1%), не раств. в диэтиловом эфире.
T. аммония NH4BF4 — бесцветные кристаллы с ромбич. решеткой (а = 0,906 нм, b = 0,564 нм, с = 0,723 нм, z = 4, пространственная группа Рпта); плотн. 1,88 г/см3; при 199,5 °C переходит в кубич. модификацию (а = 0,755 нм); т. пл. 487 °C (под давлением); т. возг. 350 °C; раств. в воде (20,5% по массе при 25 °C), плохо — в этаноле (0,7%), не раств. в ацетоне, бензоле, хлороформе, пиридине.
T. натрия, калия и аммония — компоненты электролитов при рафинировании и получении покрытий цветных металлов, флюсов для сварки и пайки, формовочных составов при литье Al и Mg и их сплавов, добавки к смазочно-охлаждающим жидкостям при обработке металлов давлением, фторирующие агенты, гербициды. T. лития и натрия — исходные вещества для получения тетрагидридоборатов, T. аммония — консервант для древесины, антипирен для полимеров. T. тяжелых металлов (Fe, Zn, Hg и др.) — катализаторы реакций полимеризации, гидролиза, формилирования и др. в орг. синтезе. Такие Т., как NF4BF4, N2F5BF4, используются в хим. лазерах. T. нитрозила и нитрозония — реагенты для нитрозирования и нитрования в орг. синтезе. T. орг. оснований используют в орг. синтезе, в частности для фторирования.
Известны соли и др. фтороборных, а также оксо- и гидро-ксофтороборных кислот, в частности гидроксотрифтороборной и дигидроксодифтороборной кислот (эти кислоты иногда рассматривают как гидраты BF3), напр. K2B2F9, NaHBF3, BaBOF3, KBF3(OH).
Лит. см. при ст. бора трифторид.
П. И. Федоров
