активность
I
АКТИВНОСТЬ катализатора
свойство катализатора ускорять химическую реакцию. Количественно А. определяют как скорость реакции в данных условиях за вычетом скорости той же реакции в отсутствие катализатора. Значение А. используют в технол. расчетах, для сравнит. оценки катализаторов при их подборе, для характеристики качества катализатора. В технол. расчетах А. обычно выражают через скорость реакции, отнесенную к единице объема или массы катализатора. Для сравнит. характеристики катализаторов в гомог. катализе используют также скорость реакции, отнесенную к единице концентрации катализатора, в гетерогенном — к единице поверхности катализатора (т. наз. удельную активность катализатора). Часто с этой же целью скорость реакции относят к одному активному центру катализатора; в гетерог. катализе эта величина наз. числом оборотов реакции.
Для сравнения ряда катализаторов используют также значения констант скорости реакции (если ее порядок не меняется на разл. катализаторах) или энергию активации реакции (если не меняется предэкспоненциальный множитель в уравнении Аррениуса). Иногда сопоставляют степени превращ. реакц. смеси заданного состава при одинаковых условиях реакции, однако такой способ оценки А. является приближенным, его погрешность возрастает с увеличением измеряемой степени превращ.; для реакций, тормозящихся образующимся продуктом, этот способ неприемлем.
Лит. см. при ст. катализ.
А. Я. Розовский
II
АКТИВНОСТЬ термодинамическая
величина, позволяющая представлять в удобной для практич. использования форме концентрац. зависимость хим. потенциалов компонентов реального раствора. С помощью этой величины можно применять к реальному раствору термодинамич. соотношения, относящиеся к идеальному раствору, если заменить в них концентрации активностями. Отношение А. компонента к его концентрации наз. коэф. активности.
Хим. потенциал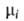 и активность а,- i-того компонента раствора по определению связаны соотношением:
и активность а,- i-того компонента раствора по определению связаны соотношением:
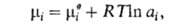
где R — газовая постоянная, T — температура, 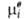 -хим. потенциал компонента в определенным образом выбранном стандартном состоянии. Значения
-хим. потенциал компонента в определенным образом выбранном стандартном состоянии. Значения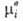 зависят только от T и давления р; ai — функция Т, р и состава раствора. Таким образом, введение понятия А. позволяет разделить выражение для хим. потенциала на две части: постоянную при данных Т и р
зависят только от T и давления р; ai — функция Т, р и состава раствора. Таким образом, введение понятия А. позволяет разделить выражение для хим. потенциала на две части: постоянную при данных Т и р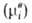 и зависящую от состава (RTlnai). Это разделение условно, поскольку численное значение ai зависит от выбора стандартного состояния. В стандартном состоянии ai = 1.
и зависящую от состава (RTlnai). Это разделение условно, поскольку численное значение ai зависит от выбора стандартного состояния. В стандартном состоянии ai = 1.
Для компонентов жидких растворов неэлектролитов чаще всего в качестве стандартного выбирают состояние чистой жидкости при температуре и давлении раствора с хим. потенциалом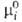 (Т, р). Тогда
(Т, р). Тогда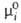 =
=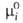 при мольной доле Ni = 1, активность ai и коэф. активности
при мольной доле Ni = 1, активность ai и коэф. активности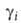 =ai/Ni равны единице. В растворе
=ai/Ni равны единице. В растворе
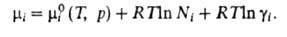
Если раствор ведет себя как идеальный, то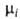 ид =
ид =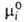 + RT1nNi. Знак разности
+ RT1nNi. Знак разности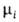 —
—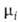 нд = RT\
нд = RT\
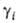 определяет знак отклонения поведения реального раствора от идеального: при
определяет знак отклонения поведения реального раствора от идеального: при
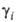 > 1 отклонение от идеальности положительно, при
> 1 отклонение от идеальности положительно, при
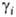 < 1 — отрицательно. Выбор чистых веществ в качестве стандартных состояний для всех компонентов раствора наз. симметричной нормировкой А.; ее применяют в тех случаях, когда все компоненты раствора рассматриваются как равноправные.
< 1 — отрицательно. Выбор чистых веществ в качестве стандартных состояний для всех компонентов раствора наз. симметричной нормировкой А.; ее применяют в тех случаях, когда все компоненты раствора рассматриваются как равноправные.
При т. наз. несимметричной нормировке А. стандартным состоянием для растворителя (компонент 1) служит чистая жидкость 1, как и при симметричной нормировке,
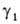 = 1 при Ni = 1. Для растворенного вещества (компонент 2) принимают, что его А. совпадает с концентрацией и коэф. активности равен единице в предельно разб. растворе. Иначе говоря, стандартное состояние для этого компонента выбирают т. обр., чтобы
= 1 при Ni = 1. Для растворенного вещества (компонент 2) принимают, что его А. совпадает с концентрацией и коэф. активности равен единице в предельно разб. растворе. Иначе говоря, стандартное состояние для этого компонента выбирают т. обр., чтобы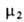 было равно его хим. потенциалу
было равно его хим. потенциалу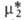 в гипотетич. растворе единичной концентрации, в котором коэф. активности равен единице. Стандартный хим. потенциал
в гипотетич. растворе единичной концентрации, в котором коэф. активности равен единице. Стандартный хим. потенциал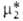 определяют линейной экстраполяцией к единичной концентрации зависимости типа
определяют линейной экстраполяцией к единичной концентрации зависимости типа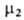 =
=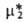 + RTlnN2, которая отвечает Генри закону и выполняется лишь при достаточно малых N2. В зависимости от способа выражения концентрации (мольная доля N2, молярность с, моляльность m) стандартный хим. потенциал растворенного вещества принимает разл. значения; соотв. и А. растворенного вещества имеет разл. значения:
+ RTlnN2, которая отвечает Генри закону и выполняется лишь при достаточно малых N2. В зависимости от способа выражения концентрации (мольная доля N2, молярность с, моляльность m) стандартный хим. потенциал растворенного вещества принимает разл. значения; соотв. и А. растворенного вещества имеет разл. значения:
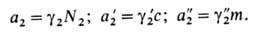
Для растворов электролитов применяют, как правило, несимметричную нормировку А. компонентов, но с учетом электролитич. диссоциации. А. сильного электролита, диссоциирующего на v1 катионов и v2 анионов в растворе моляльности т, представляют соотношением: a = v1vlv2v2(m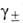 )v, где v = = v1 + v2 и
)v, где v = = v1 + v2 и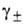 — т. наз. средний ионный коэф. активности;
— т. наз. средний ионный коэф. активности; 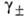 → 1 при m → 0. Аналогично м. б. записана А. и при др. способах выражения концентрации.
→ 1 при m → 0. Аналогично м. б. записана А. и при др. способах выражения концентрации.
А. всех компонентов раствора связаны между собой Гиббса-Дюгема уравнением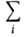 Nidlnai, = 0 (при постоянных Т и р).
Nidlnai, = 0 (при постоянных Т и р).
Это позволяет рассчитывать А. одного из компонентов по данным о концентрац. зависимости всех остальных, а также проверять найденные к.-л. образом значения А. всех компонентов на их термодинамич. согласованность.
Эксперим. определение А. компонентов раствора возможно разл. методами, напр. криоскопией, осмометриеп. А. летучего компонента обычно определяют по измерениям давления пара, учитывая связь А. с летучестью-, если fi и f 0i — летучести i-того компонента в растворе и в стандартном состоянии соотв., то ai -fi/f0i. Для системы, в которой пар ведет себя как идеальный, ai- = pi/p0i, где р,-парциальное давление компонента над раствором, р,-- давление пара чистой жидкости.
Характер концентрац. зависимости А. вещества в том или ином растворе определяется особенностями межмолекулярных взаимодействий в нем. Теоретич. расчет А. возможен методами статистич. термодинамики; для практич. расчетов широко используют приближенные модели, напр., регулярного раствора, атермич. раствора, групповые модели (см. растворы неэлектролитов). Для сильных электролитов А. в первом приближении описывается теорией Дебая — Хюккеля (см. растворы электролитов). Определение активностей и коэф. активности веществ важно при расчетах фазовых и хим. равновесий. Так, общее условие фазового равновесия, заключающееся в равенстве хим. потенциалов данного компонента в каждой из фаз, отвечает условию равенства А. этого компонента, если они определены по отношению к одному и тому же стандартному состоянию.
Понятия А. и коэф. активности введены Г. Льюисом в 1907.
Лит.: Карапетьянц М.Х., Химическая термодинамика, 3 изд., М., 1975; Робинсон Р., Стоке Р., Растворы электролитов, пер. с англ., М„ 1963; Термодинамика разбавленных растворов неэлектролитов, Л., 1982.
Значения в других словарях
- АКТИВНОСТЬ — Радиоактивного источника, число радиоакт. распадов в ед. времени. Единице А. в системе СИ — беккерелю (Бк) — соответствует 1 распад в 1 с. Внесистемная ед. кюри (Ки) равна 3,7•1010 Бк. А., приходящаяся на ед. массы в-ва источника, наз. удельной А. Физический энциклопедический словарь
- активность — -и, ж. Свойство по прил. активный 1 (в 1 знач.); деятельное участие в чем-л., энергичная деятельность; противоп. пассивность. Проявлять активность. Малый академический словарь
- АКТИВНОСТЬ — АКТИВНОСТЬ (от лат. activus — деятельный) — англ. activity; нем. Aktivitat. Деятельность в самом широком смысле слова, один из основополагающих элементов человеческого поведения. Социологический словарь
- Активность — Термодинамическая, величина, характеризующая стремление вещества выделиться из раствора. А. компонента жидкого или твёрдого раствора пропорциональна давлению пара этого компонента над раствором (при условии, что газовая фаза является идеальной). Большая советская энциклопедия
- активность — АКТИВНОСТЬ - боевая ~. Количество атакующих и защитных действий боксера в единицу времени. - ~ борца. Оценка действий борца в схватке. Словарь спортивных терминов
- активность — • бешеная ~ • большая ~ • высокая ~ • излишняя ~ • исключительная ~ • максимальная ~ • наибольшая ~ • небывалая ~ • невероятная ~ • необычайная ~ • огромная ~ • чрезмерная ~ Словарь русской идиоматики
- активность — АКТИВНОСТЬ и, ж. actif, activité. Деятельное участие в чем-л. МАС-1. Активность и пассивность перепутались в нем самым капризным образом. Словарь галлицизмов русского языка
- активность — активность , -и Орфографический словарь. Одно Н или два?
- активность — Акти́в/н/ость/. Морфемно-орфографический словарь
- активность — орф. активность, -и Орфографический словарь Лопатина
- АКТИВНОСТЬ — См. Небылицын В. Д. Большой психологический словарь
- активность — АКТИВНОСТЬ — ПАССИВНОСТЬ Проявлять активность — проявлять пассивность. ○ Студенческая жизнь злила меня пассивностью — слушай лекции, учи, сдавай зачеты и опять слушай. Хотелось активности, действий, институт воспринимался как перевал на пути. Словарь антонимов русского языка
- Активность — В биологии — фундаментальное свойство живых организмов, выражающееся в их способности, преодолевая или используя внешние воздействия для реализации своих потребностей, целесообразно реагировать на факторы внешней среды. Медицинская энциклопедия
- активность — АКТИВНОСТЬ 1. АКТИВНОСТЬ, -и; ж. Деятельное участие в чём-л. (противоп.: пассивность). Познавательная, творческая а. А. общественных организаций. Проявлять а. // Усиленная, энергичная деятельность (о действии природных сил, социальных процессов и т.п.). Толковый словарь Кузнецова
- активность — См. акт Толковый словарь Даля
- активность — активность I ж. Отвлеч. сущ. по прил. активный I II ж. разг. Самопроизвольное превращение неустойчивых атомных ядер в ядра других радиоактивных элементов, сопровождающееся радиоактивным излучением (радиацией); радиоактивность. Толковый словарь Ефремовой
- активность — АКТ’ИВНОСТЬ, активности, мн. нет, ·жен. (·книж. ). ·отвлеч. сущ. к активный. Активность характера. | Активная, энергичная деятельность. Проявлять активность. Только активность широких трудящихся масс может разрешить задачу индустриализации страны. Толковый словарь Ушакова
- активность — [от лат.] – 1) усиленная деятельность; деятельное состояние; 2) способность организма реагировать на внешние раздражения Большой словарь иностранных слов
