алюминия фосфаты
АЛЮМИНИЯ ФОСФАТЫ
Ортофосфат (фосфат) А1PO4 — бесцветные кристаллы. Имеет четыре устойчивые кристаллич. модификации: до 580 °C устойчив α-берлинит с гексаген, решеткой [а = 0,49429 нм, с = 1,09476 нм, z = 3, пространственная группа P311; плотн. 2,64 г/см3; C0p 93,2 Дж/(моль — К); ΔЯ°б −1733 кДж/моль, Δ G°обр -1617кДж/моль; S0298 90,8 Дж/(моль∙К)]; при 580–705 °C -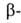 берлинит с гексагон. решеткой (а = 0,5038 нм, с = = 1,1063 нм, z = 6; ΔН° перехода
берлинит с гексагон. решеткой (а = 0,5038 нм, с = = 1,1063 нм, z = 6; ΔН° перехода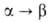 1,30 кДж/моль); при 705–1047 °C — гексагон. модификация (ΔН° перехода 1,09 кДж/моль); выше 1047 °C — кубическая (а = 0,71956 нм, z = 4). Известны также две метастабильные модификации. Ортофосфат устойчив до 1650 °C. Не раств. в воде, реагирует с кислотами и щелочами. Монокристаллы берлинита, являющиеся пьезоэлектриками, выращивают гидротермальными методами при 130–180 °C из растворов Al2O3 в конц. H3PO4 (6 моль/л) при атомном отношении А1 : Р = 2,3–4,5.
1,30 кДж/моль); при 705–1047 °C — гексагон. модификация (ΔН° перехода 1,09 кДж/моль); выше 1047 °C — кубическая (а = 0,71956 нм, z = 4). Известны также две метастабильные модификации. Ортофосфат устойчив до 1650 °C. Не раств. в воде, реагирует с кислотами и щелочами. Монокристаллы берлинита, являющиеся пьезоэлектриками, выращивают гидротермальными методами при 130–180 °C из растворов Al2O3 в конц. H3PO4 (6 моль/л) при атомном отношении А1 : Р = 2,3–4,5.
Из водных растворов солей А1 при действии эквивалентного количества ортофосфата щелочного металла в водном растворе при pH 4,0–4,5 осаждается аморфный фосфат А1PO4*хH2O — катализатор дегидратации спиртов, гидратации непредельных углеводородов, изомеризации эпоксисоединений в альдегиды и др. При нагр. аморфного фосфата вместе с маточником в запаянной ампуле при 100–110 °C кристаллизуется дигидрат с ромбич. кристаллической решеткой (в природе минерал варисцит) либо с моноклинной решеткой (метаварисцит).
Кислые ортофосфаты А1H3(PO4)2*3H2O, А1H3(PO4)2*2H2O и А1(H2PO4)3*H2O выделены из систем А1PO4-H3PO4-H2O, образующих вязкие пересыщенные растворы, в которых атомное отношение Р : А1 может достигать ~2,3. Такие растворы используют как алюмофосфатную связку в производстве безобжиговых керамич. материалов, для получения покрытий на металлах. В смесях с корундом, кварцем и др. наполнителями они образуют на холоду прочную монолитную массу, которая при нагр. подвергается поликонденсации с образованием водостойких стеклообразных полифосфатов [А1(PO3)3]Х, обладающих хорошей адгезией к металлам и керамич. материалам.
Лит.: Корбридж Д., Фосфор. Основы химии, биохимии и технологии, пер. с англ., М., 1982, с. 135–39; Moffat J.B., "Topics Phosphorus Chemistry", 1980, v. 10, № 10.
А. В. Лавров, Л. В. Кубасова
