алюминия фторид
АЛЮМИНИЯ ФТОРИД AlF3
бесцветные кристаллы. При обычных условиях устойчива α-модификация с тригон. решеткой (а = 0,5039 нм, 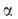 58,50°, z = 2, пространственная группа R32); плотн. 1,882 г/см3. Известна также устойчивая до 710–720 °C
58,50°, z = 2, пространственная группа R32); плотн. 1,882 г/см3. Известна также устойчивая до 710–720 °C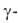 модификация с тетрагон. решеткой (а = = 0,354 нм, с = 0,600нм). Т. возг. 1270 °C; C0p 75,10 Дж/(моль∙К); ΔH0возг 272 кДж/моль, ΔH0обр −1510 кДж/моль; S0298 66,48 Дж/(моль∙К); уравнения температурной зависимости давления пара: Igp(Па) = 16,565 — 16967/Т (980
модификация с тетрагон. решеткой (а = = 0,354 нм, с = 0,600нм). Т. возг. 1270 °C; C0p 75,10 Дж/(моль∙К); ΔH0возг 272 кДж/моль, ΔH0обр −1510 кДж/моль; S0298 66,48 Дж/(моль∙К); уравнения температурной зависимости давления пара: Igp(Па) = 16,565 — 16967/Т (980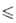 Т
Т 1123 К), lg р (Па) = 14,719- 14974/Т (1027
1123 К), lg р (Па) = 14,719- 14974/Т (1027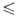 Т
Т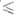 1184 К).
1184 К).
А. ф. плохо раств. в воде (0,41% по массе при 25 °C), лучше — в растворах HF, не раств. в органических растворителях. Образует кристаллогидраты с 1, 3 и 9 молекулами воды. При нагр. гидролизуется парами воды, медленно взаимод. с конц. H2SO4, разлагается растворами и расплавами щелочей.
Получают А. ф.: взаимод. Al2O3 или А1(OH)3 с раствором HF с послед. выделением, сушкой и прокаливанием при 500–600 °C образовавшегося A1F3-3H2O; действием на Al2O3 газообразного HF при 450–600 °C; по реакции 2А1(OH)3 + H2SiF6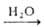 2A1F3*ЗH2O + SiO2*nH2O с послед. выделением, сушкой и прокаливанием гидрата; взаимодействие А1(OH)3 с раствором NH4F или безводным NH4HF2 с последующим разложением образовавшегося (NH4)3 [A1F6] при 450–550 °C
2A1F3*ЗH2O + SiO2*nH2O с послед. выделением, сушкой и прокаливанием гидрата; взаимодействие А1(OH)3 с раствором NH4F или безводным NH4HF2 с последующим разложением образовавшегося (NH4)3 [A1F6] при 450–550 °C
А. ф. — компонент электролита (5–7%) в производстве А1; входит в состав флюсов, эмалей, стекол, глазурей, керамики, покрытий сварочных электродов; катализатор в орг. синтезе. Обратимую реакцию A1F3 с А1 используют для очистки металла.
Известны гидратированные оксифториды А1, напр. A12OF4*3,5H2O, гидроксифториды и существующий только в газовой фазе монофторид A1F. С фторидами щелочных металлов A1F3 образует фтороалюминаты.
Гексафтороалюминат натрия Na3[AlF6] — бесцветные кристаллы; т. пл. 1011 °C (с разл.); плотн. низкотемпературной α-модификации (криолита) 2,97 г/см3; C0p 216 Дж/(моль∙К); ΔH0обр −3312 кДж/моль, ΔG°обр −3148 кДж/моль; S0298 238 Дж/(моль∙К); плохо раств. в воде (0,42% по массе при 25 °C) и органических растворителях; взаимод. с конц. H2SO4; при нагр. гидролизуется парами воды. Расплав Na3 [A1F6] электропроводен и является хорошим растворителем для Al2O3 и др. оксидов. Криолит получают: действием Na2CO3 или NaF на раствор А1(OH)3 или Al2O3 в HF; взаимод. водных растворов A1F3 и NaF; взаимод. А1(OH)3 и Na2CO3 или NaAlO2 с водным раствором NH4F. Криолит- редкий в природе минерал; осн. компонент (80–85%) электролита в производстве А1; металлургич. флюс; компонент стекол и эмалей; наполнитель резин.
Гексафтороалюминат аммония (NH4)3 [A1F6] бесцветные кристаллы; плотн. 1,837 г/см3 (20 °C); ΔH0обр −3060 кДж/моль; при нагр. разлагается последовательно до NH4[A1F4] и A1F3; раств. в воде (7,66% по массе при 25 °C), не раств. в органических растворителях. Получают взаимод. А1(OH)3 и Al2O3 с NH4F или NH4HF2. Промежут. продукт в производстве A1F3.
Лит.: Пустильник Г. Л., Вольфсон Г. И., Галков А. С, Производство фтористых солей для алюминиевой промышленности за рубежом, М., 1976.
Э. Г. Раков
Значения в других словарях
- Алюминия фторид — Фтористый алюминий, AIF3, соль, бесцветные кристаллы, плотность 3100 кг/м2. При нагревании возгоняется без плавления. В воде очень мало растворим (0,559 г в 100 г H2O при 25°С), со щелочами и кислотами (кроме кипящей серной) не реагирует. А. Большая советская энциклопедия
- АЛЮМИНИЯ ФТОРИД — АЛЮМИНИЯ ФТОРИД — AlF3, бесцветные кристаллы. Плохо растворяется в воде. Входит в состав электролита для получения и очистки алюминия. Большой энциклопедический словарь
