алюминийорганические соединения
АЛЮМИНИЙОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
содержат связь Al—С; общая формула RnAlХ3-n где R — орг. радикал; Х-Hal, H, OR, SR, NR2, RCOO, CN и др.; п = 1–3. Различают симметричные, или полные, А. с. (п = 3) и несимметричные, или смешанные.
А. с. чувствительны к влаге и O2 воздуха (соед. до C5 на воздухе самовоспламеняются). Поэтому все работы с А.с. выполняются в атмосфере сухого инертного газа, напр. азота или аргона. Alk3Al (см. табл.) — бесцв. жидкости, Ar3Al — твердые вещества, растворимые в органических растворителях.
Некоторые А.с. — электрононенасыщенные соед., что обусловливает склонность их молекул к ассоциации друг с другом. В образующихся димерах и тримерах атомы Al соединены через орг. радикалы трехцентровыми мостиковыми связями. Известны также А.с. типа R2Al—A1R2. С донорами электронов, напр. аминами и эфирами, А. с. образуют прочные аддукты состава 1 :1, с анионными донорами MR или MX, где М — щелочной или щел.-зем. металл, — солеобразные комплексы типа М [RnAlX4-n] (т. наз. ат-комплексы).
СВОЙСТВА АЛЮМИНИЙОРГАНИЧЕСКИХ СОЕДИНЕНИЙ

Основные реакции А.с.: 1) бурное взаимод. с водой, кислотами, спиртами, аминами и др. протонсодержащими соед. с выделением углеводородов, напр.: R3Al + nHOR' → R3-nAl(OR')n + nRH; 2) окисление с образованием алкоголятов: R3Al + 1,5O2 → (RO)3Al; 3) реакция с CO2, приводящая к карбоновым кислотам: R3Al + CO2 → R2AlOC(O)R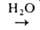 RCOOH; 4) взаимод. с галогенидами, оксидами и алкоголятами элементов более электроотрицательными, чем А1 (В, Ga, Si, Sn, Pb и др.), с образованием их алкилпроизводных, напр.: R3Al + ЭНа1n → RmЭHaln-m + А1На13 (п
RCOOH; 4) взаимод. с галогенидами, оксидами и алкоголятами элементов более электроотрицательными, чем А1 (В, Ga, Si, Sn, Pb и др.), с образованием их алкилпроизводных, напр.: R3Al + ЭНа1n → RmЭHaln-m + А1На13 (п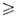 т; п = 2, 3 или 4); 5) перераспределение орг. радикалов между симметричными А. с. и галогенидами или алкоголятами Al, напр.: 2R3Al + А1Х3 → 3R2AlX; R3Al + 2А1Х3 → 3RA1X2; 6) реакция с олефинами, в результате которой получают высшие А.с.:
т; п = 2, 3 или 4); 5) перераспределение орг. радикалов между симметричными А. с. и галогенидами или алкоголятами Al, напр.: 2R3Al + А1Х3 → 3R2AlX; R3Al + 2А1Х3 → 3RA1X2; 6) реакция с олефинами, в результате которой получают высшие А.с.: 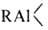 + nCH2=CH2 → R—(—CH2CH2—)n—
+ nCH2=CH2 → R—(—CH2CH2—)n—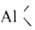 Способы получения А.с.: 1) взаимод. олефинов с А1 и H2, напр.: 6CH2=CH2 + 2А1 + 3H2 → 2(C2H5)3А1 (осн. пром. способ); 2) реакция олефинов или ацетиленов с гидридами А1 (г и д р о а л ю м и н и р о в а н и е), напр.: 3CH2=CHR + А1H3 → (RCH2CH2)3Al; HC≡CR + R2AlH → R2AlCH=CHR; 4CH2=CHR + МА1H4 → (RCH2CH2)4AlM (M=Na, Li); 3) переалкилирование триизобутилалюминия олефинами: (изо-C4H9)3А1 + 3CH2=CHR → (RCH2CH2)3Al + 3 изо-C4H8.
Способы получения А.с.: 1) взаимод. олефинов с А1 и H2, напр.: 6CH2=CH2 + 2А1 + 3H2 → 2(C2H5)3А1 (осн. пром. способ); 2) реакция олефинов или ацетиленов с гидридами А1 (г и д р о а л ю м и н и р о в а н и е), напр.: 3CH2=CHR + А1H3 → (RCH2CH2)3Al; HC≡CR + R2AlH → R2AlCH=CHR; 4CH2=CHR + МА1H4 → (RCH2CH2)4AlM (M=Na, Li); 3) переалкилирование триизобутилалюминия олефинами: (изо-C4H9)3А1 + 3CH2=CHR → (RCH2CH2)3Al + 3 изо-C4H8.
Симметричные А. с. получают также реакцией галогенидов А1 с реактивами Гриньяра или алкиллитием, действием диалкилртути на А1, дегалогенированием несимметричных А.с. (напр., 3R2AlHal + 3Na → 2R3Al + 3NaHal + А1). Несимметричные А. с. синтезируют взаимод. алкилгалогенидов с А1, напр.: 3RHal + 2Al → R2AlHal + RAlHal2.
Элементный анализ А.с. заключается в сожжении навески в токе O2 с послед. определением С и Н гравиметрич. методом и одновременно А1 — по количеству образовавшегося Al2O3. Определение А1 возможно также обычными методами неорг. анализа после гидролиза или алкоголиза А. с. Состав образующихся при этом газообразных веществ устанавливают с помощью ГЖХ.
А. с. — компоненты катализаторов Циглера — Натты, используемых в синтезе полиолефинов и стереорегулярных диеновых каучуков, катализаторы стереоспецифич. полимеризации полярных мономеров, напр. ацетальдегида, окисей олефинов, капролактама, а также синтеза α-олефинов нормального строения и др. На основе А. с. разработаны методы получения высших жирных спиртов нормального строения высших жирных кислот, тетраэтилсвинца, а также металлич. А1 высокой чистоты. Алюминийалкилы — восстановители при получении карбонилов Mn, Cr, Mo и др., диалкилалюминийгидриды и комплексы типа M[R2AlH2]-мягкие восстановители в орг. синтезе. Мировое производство А. с. составляет десятки тыс. т/год (1982).
• см. также диэтилалюминийхлорид, триизобутилалюминий, триэтилалюминий
Лит.: Несмеянов А. Н., Соколик Р.А., в кн.: Методы элементоорганической химии. Бор, алюминий, галлий, индий, таллий, под ред. А.Н. Несмеянова и К.А. Кочешкова, М., 1964, с. 283–385; Комплексы металлоорганических, гибридных и галоидных соединений алюминия, М., 1970; Корнеев Н.Н., Химия и технология алюминийорганических соединений, М., 1979; Толстиков Г.А., Юрьев В. П., Алюминийорганический синтез, М., 1979.
В. В. Гаврилето
Значения в других словарях
- Алюминийорганические соединения — Металлоорганические соединения, в которых алюминий связан непосредственно с атомом углерода. А. с. известны двух типов: полные R3Al и неполные R2AlX или RAIX2 (где R — CH3, C2H5, C6H5 и др., а Х — галоген, OR или Н). Большая советская энциклопедия
- АЛЮМИНИЙОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ — АЛЮМИНИЙОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ — содержат в молекуле атом алюминия, непосредственно связанный с углеродом. Известны алюминийорганические соединения типа R3Al, R2AlX, RAlX2, где R — органический радикал, Х — галоген, водород или OR. Большой энциклопедический словарь
