алкоксисиланы и ароксисиланы
АЛКОКСИСИЛАНЫ И АРОКСИСИЛАНЫ [эфиры орто-кремниевой кислоты, алкил(арил)силикаты]
соединения общих формул Si(OR)4 и Rn' Si(OR)4_n (замещенные А. и а.), где R = Alk, Ar; R' = H, Alk, Ar, Hal и др.; п = 0–3 (см. табл.). Алкоксисиланы (Ал.) — бесцветные жидкости со слабым эфирным запахом. Ароксисиланы (Ар.) — бесцв. вязкие жидкости или кристаллы. Ал., содержащие группы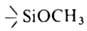 или
или 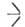 SiOC2H5, распадаются выше 200 °C по реакции: 2
SiOC2H5, распадаются выше 200 °C по реакции: 2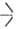 SiOR → ROR +
SiOR → ROR +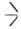 SiOSi
SiOSi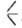 .
.
СВОЙСТВА АЛКОКСИСИЛАНОВ И АРОКСИСИЛАНОВ

С увеличением длины и (или) разветвленности алкильных радикалов термостабильность Ал. уменьшается; в продуктах их распада присутствуют насыщ. и ненасыщ. углеводороды. Ар. термостабильны до 370–420 °C. Основные реакции:
1. Гидролиз: 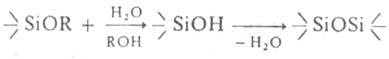 , где R = CH3, C2Н<, C6H5. Катализаторы-кислоты, щелочи, амины, алкоголяты Af, Ti и др. Реакция ускоряется в среде гомогенизирующего (смешивающегося с водой) растворителя, напр. этанола, ацетона. Процесс экзотермичен. Полный гидролиз Ал. приводит к SiO2, частичный — к полиалкоксисилоксанам. Соед. с пространственно емкими орг. радикалами, напр. тетрабутокси- и днфенилдикрезоксисиланы, в обычных условиях не гидролизуются.
, где R = CH3, C2Н<, C6H5. Катализаторы-кислоты, щелочи, амины, алкоголяты Af, Ti и др. Реакция ускоряется в среде гомогенизирующего (смешивающегося с водой) растворителя, напр. этанола, ацетона. Процесс экзотермичен. Полный гидролиз Ал. приводит к SiO2, частичный — к полиалкоксисилоксанам. Соед. с пространственно емкими орг. радикалами, напр. тетрабутокси- и днфенилдикрезоксисиланы, в обычных условиях не гидролизуются.
2. Переэтерификация: — SiOR + R'OH ⇄ —SiOR'+ ROH (R'= Alk, Ar). Катализаторы — кислоты, алкоголяты щелочных металлов, Al, Fe или Ti, амины, амиды и др. Реакцию используют для замещения низших R на высшие, напр. при получении арилароксисиланов.
3. Силанолиз: 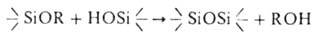 . На этой реакции в присутствии катализатора (октаноат Sn, диалкилдиацилоксистаннаны, цинковые, свинцовые, аммониевые соли орг. кислот) основана "холодная" вулканизация полисилоксандиолов при помощи Ал., широко применяемая, напр., для отверждения герметиков.
. На этой реакции в присутствии катализатора (октаноат Sn, диалкилдиацилоксистаннаны, цинковые, свинцовые, аммониевые соли орг. кислот) основана "холодная" вулканизация полисилоксандиолов при помощи Ал., широко применяемая, напр., для отверждения герметиков.
4. Взаимод. Ал. с металлоорг. соед., напр.: Si(OC2H5)4 + nRMgCl → R,,Si(OC2H5)4-n + MC2H5OMgCl. Реакцию используют в промышленности для синтеза алкил- и арилалкоксисиланов, последующим гидролизом которых в присутствии HCl получают полиорганосилоксаны. Катализирует реакцию исходный Ал. Алкилирующими агентами могут служить также литий-, цинк- и алюминийалкилы.
5. Гетерофункциональная конденсация Ал. по схеме:
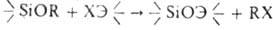 , где Э = Si, Sn, Ti и др.,
, где Э = Si, Sn, Ti и др.,
X = Cl, RCOO. В реакции с хлор- и ацетоксисиланами катализаторы-H2SO4, HCl, FeCl3, A1C13, соед. Sn, алкоголяты Na и др.; температура — от комнатной до 200 °C.
6. Обмен функц. групп, напр.: 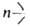 SiOR + ХnЭ → n—SiX + (RO)n3, где Э = Si, В, Al, Ti и др., X = OR, Ar, Hal и др. Катализируют сильные кислоты, хлориды Fe и А1, соед. Sn и др.; с галогенидами В реакция идет без катализатора при температурах от −120 до −70 °C, с
SiOR + ХnЭ → n—SiX + (RO)n3, где Э = Si, В, Al, Ti и др., X = OR, Ar, Hal и др. Катализируют сильные кислоты, хлориды Fe и А1, соед. Sn и др.; с галогенидами В реакция идет без катализатора при температурах от −120 до −70 °C, с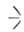 SiAr — в присут. щелочного катализатора при 150–230 °C. Склонность к обмену групп OR тем меньше, чем больше разветвленность R и число заместителей у Si.
SiAr — в присут. щелочного катализатора при 150–230 °C. Склонность к обмену групп OR тем меньше, чем больше разветвленность R и число заместителей у Si.
7. Расщепление по связям О—С при действии щелочных металлов, их гидроксидов или алкоголятов, карбоновых и неорг. кислот, их ангидридов, а в присутствии сильных кислот — при действии простых и сложных эфиров, альдегидов, кетонов.
Осн. метод синтеза Ал.-этерификация хлорсиланов спиртами при 20–40 °C (на завершающей стадии — при температуре кипения спирта): 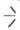 SiCl + HOR
SiCl + HOR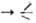 SiOR + HCl. Спирт обычно берут с избытком 5–10%. Побочный процесс — взаимод. спирта и HCl с образованием хлоралкила и воды, которая ги-дролизует хлор- и алкоксисиланы до силоксанов.
SiOR + HCl. Спирт обычно берут с избытком 5–10%. Побочный процесс — взаимод. спирта и HCl с образованием хлоралкила и воды, которая ги-дролизует хлор- и алкоксисиланы до силоксанов.
Группы OCH3 и OC2H5 определяют реакцией Ал. с НI-кислотой и послед, анализом RI методом бромометрии или ГЖХ, алкоксигруппы до C8-ацетилированием Ал. уксусным ангидридом и титрованием избытка ангидрида раствором щелочи. Методы определения ароксигрупп-потенциометрич. титрование ароксисилана раствором (C4H9)2NOH в смеси диэтиламина с ацетоном или гидролиз Ар. с послед. определением фенола кулонометрич. титрованием с применением электрогенерированного брома.
Ал. используют в синтезе др. кремнийорг. продуктов; напр., из тетраэтоксисилана получают алкил(арил)этоксисиланы, из триэтоксисилана-фтор-, амино- и цианорганоэтоксисиланы, из винилтриэтоксисилана (по реакции Арбузова) — фосфоркремнийорг. соединения. Ал. служат также вулканизующими агентами для кремнийорг. и др. полимеров (напр., тетраэтоксисилан), аппретами наполнителей композиц. полимерных материалов (напр., винилтриэтоксисилан, аминорганоэтоксисиланы). Арокси- и арилароксисиланы-теплоносители, используемые при температурах до 400 °C.
Ал. токсичны, имеют скрытый период действия, обладают кумулятивными свойствами. ПДК (мг/м3): для тетраэтоксисилана-20, для тетраметоксисилана-5, для триэтоксисилана-1. ЛД50 (мг/кг; мыши, перорально): для метилфенилдиметоксисилана — 680, для дифенилдиксилилоксисилана — 40 000.
• см. также тетраэтоксисилан. Об олигомерных эфирах ортокремниевой кислоты см. этилсиликаты, об аминоорганоалкоксисиланах и ацетоксисиланах — кремнийорганические соединения.
Лит.: АН д риано в К. А., в кн.: Методы элементоорганической химии. Кремний, под ред. А. Н. Несмеянова и К. А. Кочешкова, М., 1968. с. 175–201; Воронков М. Г., Мнлешкевич В. П., Южелевский Ю. А.. Силоксановая связь, Новосиб., 1976. с. 188–317; X анана ш ви л и Л. М.. Андрианов К.А.. Технология элементоорганнческнх мономеров и полимеров, 2 изд., М., 1983, с. 92–130.
Е. А. Чернышев, А. С. Шапатин
