аллильные соединения
АЛЛИЛЬНЫЕ СОЕДИНЕНИЯ
содержат группировку R2C=CRCR2, где R — H или орг. остаток. К А.с. относятся аллильные CH2=CHCH2Х, металлильные CH2=С(CH3)CH2Х, кротильные CH3CH=CHCH2Х, пренильные (CH3)2С=CHCH2Х и др. соед., в которых X связан с атомом С соседним с двойной связью. Название "А. с." происходит от лат. allium- чеснок, из которого в 1844 был выделен диаллилсульфид.
Аллильная, металлильная, пренильная группы-фрагменты мн. природных соед.: витаминов, терпенов, терпе-ноидов (напр., гераниола, нерола, линалоола), антибиотиков. Во мн. эфирных маслах содержатся аллильные производные бензола, напр. эвгенол, сафрол.
В А.с. H2С=CHCH2Х, где Х-функц. группа, энергия связи С—X на 50–105 кДж/моль меньше, чем в насыщ. аналогах, и это — одна из причин их повышенной хим. активности; вторая связана с тем, что отрыв X в виде иона или своб. радикала приводит к образованию структур, в которых предполагается равномерное распределение заряда или неспаренного электрона по обоим концам цепи, напр.:
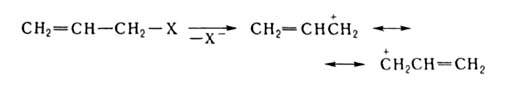
Специфич. свойство А. с. — способность к аллильной перегруппировке. Для А. с. некоторых непереходных металлов CH2=CHCH2М (М = 1/2Zn, BR2, V2Cd и др.) характерна перманентная аллильная перегруппировка (см. аллилбораны).
Аллилвиниловые или аллилариловые эфиры, сульфиды, амины и их гомологи (напр., типа CH2=CHCH2XCH=CHR и CH2=CHCH2ХАг, где X = О, NH, S) при нагр. претерпевают Коупа перегруппировку и Клайзена перегруппировку.
Замещение в А. с. происходит с сохранением двойной связи в ее первоначальном положении или сопровождается аллильной перегруппировкой.
• см. аллильное замещение
Аллильные производные Mg, Li, В и др. присоединяются к карбонильным соед. количественно с перегруппировкой (часто энантиоселективно), напр.:
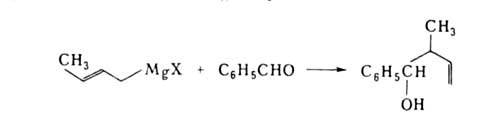
Аллилсиланы и аллилстаннаны (в отличие от алкильных производных) присоединяются к карбонильным соед. в присутствии кислот Льюиса.
Для А. с. характерны реакции непредельных соед. — присоединение, напр.:
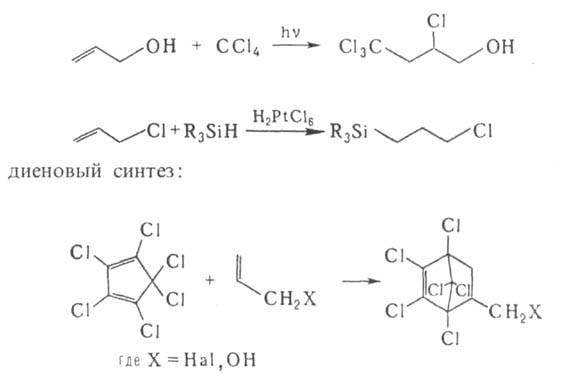
замещение активированного атома Н, находящегося в α- положении к двойной связи:
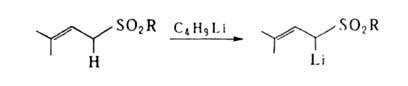
а также восстановление, окисление, полимеризация и др. Аллилгалогениды реагируют с карбонилами Mo, W, Mn, Fe,-Co и др. переходных металлов с образованием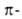 комплексов (см. аллильные комплексы переходных металлов).
комплексов (см. аллильные комплексы переходных металлов).
Практически важные способы синтеза А. с. основаны на реакциях замещения и перегруппировках, напр.:
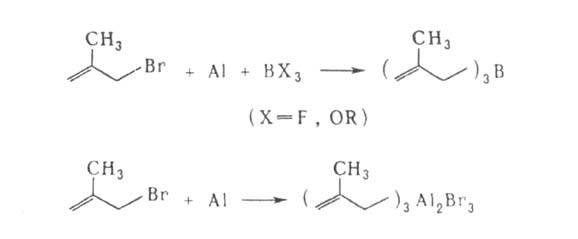
Аллилгалогениды м. б. использованы как алкилирующие агенты для получения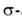 аллильных производных Mg, A1, В, Sn, Si и др., напр. триметаллилборана или металлилалюминийсесквибромида:
аллильных производных Mg, A1, В, Sn, Si и др., напр. триметаллилборана или металлилалюминийсесквибромида:
Аллиллитий образуется при взаимодействии фениллития и аллилтрифенилолова:
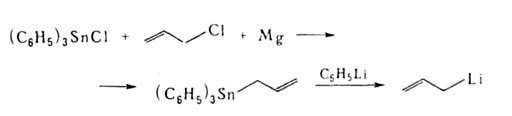
Восстановление, окисление, дегидрирование, расщепление по Гофману и др. реакции также часто используются для введения двойной связи или функц. группы с образованием А.с., напр.:
Аллилгалогениды синтезируют радикальным галогенированием алкенов и циклоалкенов бромом, N-хлор- или N-бромсукцинимидом (см. Воля — Циглера реакция). Аллил- и металлилхлориды получают хлорированием соотв. пропилена и изобутилена; аллилиодид — действием 12 и Р на глицерин; кротил- и пренилгалогениды — присоединением НХ (Х = С1, Br) к 1,3-бутадиену и изопрену, напр.:
галогенированием алкенов и циклоалкенов бромом, N-хлор- или N-бромсукцинимидом (см. Воля — Циглера реакция). Аллил- и металлилхлориды получают хлорированием соотв. пропилена и изобутилена; аллилиодид — действием 12 и Р на глицерин; кротил- и пренилгалогениды — присоединением НХ (Х = С1, Br) к 1,3-бутадиену и изопрену, напр.:
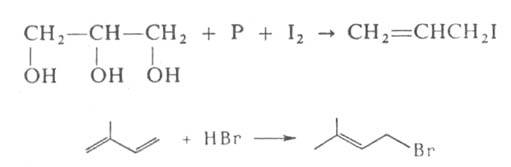
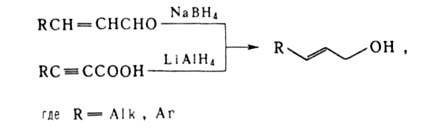
Аллильные спирты можно получать гидролизом аллилгалогенидов или окислением олефинов O2 воздуха; образующиеся вначале пероксидные соед. превращаются в спирты под действием Na2SO3, NaOH или LiAlH4:
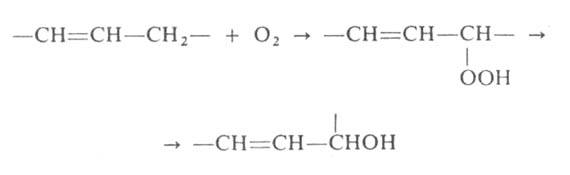
Ацетат 2-циклогексенола синтезируют нагреванием циклогексена с уксусным ангидридом и селенистой кислотой при 70 °C.
А.с. часто получают из ацетиленовых или алленовых соед., используя реакции присоединения, напр.:
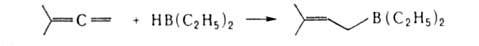
А. с. — промежут. продукты в синтезе природных соед., лек. веществ и др.
Лит.: Де-Вульф Р., Янг В., в кн.: Химия алкенов, под ред. С. Патая, пер. с англ. Л., 1969, с. 409–43; Физер Л., Физер М., Органическая химия. Углубленный курс пер. с англ., т. 1–2, М., 1966: Kirk-Othmer encyclopedia, 3 ed., v. 2, N.Y.-[a.o.], 1978, p. 97–108; NechvatalA., в кн.: Advances in freq-radical chemistry, ed. by G. H. Williams, v. 4, L.-[a.o.], 1972, p. 175–201.
Ю. Н. Бубнов
